Exercice n°1 (2 points) Répondre par vrai ou faux aux assertions suivantes.
A1. Si on double la concentration en enzyme (le substrat restant saturant), on double Vmax.
A2. ΔG0'hydrolyse [ATP -> AMP + PPi ] << ΔG0'hydrolyse [ATP -> ADP + Pi]
A3. L’hypothèse du quasi-équilibre stipule que k-1 >> kcat
A4. La liaison qui est hydrolysée quand l'ADP est formé à partir de l'ATP est une liaison ester phosphate.
Exercice n°2 (8 points). Répondre de manière claire et simple par quelques mots-clé.
- Q1. Citer les 2 types chimiques de catalyse enzymatique.
- Q2. Comment s’appelle le noyau de l’His57 impliqué dans la catalyse des protéases à sérine ?
- Q3. Comment s’appelle l’étape de formation du premier intermédiaire tétrahédrique des protéases à sérine ?
- Q4. Soit la réaction : 2A + B <=> C + 3D. Ecrire l'expression de la constante d'équilibre.
- Q5. Calculer la valeur de cette constante d'équilibre (question Q4) sachant que ΔG0' = - 3,7 kJ.mol-1.
- Q6. La réduction d'un couple rédox (Box / Bred) est couplée à l'oxydation d'un couple rédox (Aox / Ared), avec échange de 2 électrons. Ecrire les 2 demi réactions rédox.
- Q7. Que vaut ΔG°'couplage de la réaction globale précédente (question Q6) ?
- Q8. Sur quelle(s) forme(s) d'une enzyme un inhibiteur non compétitif se fixe-t-il ?
Données : T = 37°C ; R = 8,31 J.K-1.mol-1 ; F = 96500 J.V-1.mol-1 ; E°'couple B = - 0,05 V ; E°'couple A = - 0,26 V
Exercice n°3 (3 points)
|
Ci-contre, graphique issu de l’article : v0 = vitesse de transport du lactate en mmol.L-1.s-1. [S] = [Lactate] en mM. |
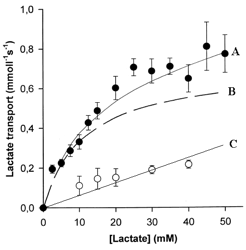 |
Q1. Quelle courbe (A, B ou C) est caractérisée par l’équation :
VMax . [S]
v0 = -------------------- + α [S]
KM + [S]
- Q2. Quelle courbe (A, B ou C) est caractérisée par l’équation : v0 = α [S]
- Q3. A quoi correspond la courbe C ?
- Q4. A quoi correspond la courbe B ?
- Q5. Comment obtient-on la courbe B ?
- Q6. Comment la vitesse de transport d’un soluté évolue-t-elle en présence d’un inhibiteur de ce soluté ?
Exercice n°4 (7 points)
On suit la cinétique d'hydrolyse d'un substrat, respectivement en absence d'inhibiteur et en présence d'un inhibiteur I1 ou d'un inhibiteur I2.Les valeurs des vitesses initiales, en UA.min-1, sont les suivantes :
| [S0] (mM) | Sans I | [I1] (9 mM) | [I2] (9 µM) |
| 0,107 | 0,0300 | 0,0175 | 0,0273 |
| 0,160 | 0,0417 | 0,0243 | 0,0366 |
| 0,253 | 0,0583 | 0,0342 | 0,0488 |
| 0,320 | 0,0700 | 0,0410 | 0,0567 |
| 0,453 | 0,0833 | 0,0487 | 0,0652 |
| 0,773 | 0,1130 | 0,0675 | 0,0822 |
| 1,160 | 0,1300 | 0,0780 | 0,0906 |
1. Déterminez VMax, KM et kcat (en s-1) à l'aide de la représentation des double inverses. Exprimez les concentrations en molarité. Ne pas tracer les courbes de saturation.
2. Déterminez les paramètres cinétiques VMaxapp et KMapp en présence de chaque inhibiteur. Calculez les constantes KI. Indiquez le type d'inhibition.
Données: [E0] = 35 nM - εMproduit = 1600 M-1.cm-1 ; l = 1 cm