Exercice n°1 (2 points)
|
A1. Une valeur d'énergie libre de Gibbs standard nulle signifie que la réaction considérée est à l'équilibre. |
|
A2. Une réaction d'oxydo-réduction impliquant le couple (2H+/H2) se déroule dans le même sens à pH 1 et à pH 14. |
|
A3. L'hypothèse du quasi-équilibre stipule que k-1 << kcat. |
|
A4. Le potentiel d'oxydo-réduction standard du couple (2H+/H2) est plus élevé à pH = 0 que dans la cellule. |
Exercice n°2 (8 points)
|
Q1. Ecrire le schéma réactionnel du système suivant :
|
|
Q2. Calculez la variation d’énergie libre de Gibbs standard dans les conditions physiologiques (ΔG°’) associée à la réoxydation du NAD réduit par l’oxygène moléculaire. |
|
Q3. Calculez le nombre théorique de molécules d'ATP susceptibles d'être synthétisées avec la VEL Gibbs calculée ci-dessus (question Q2). |
|
Q4. L’oxydation d’un couple rédox (Oox / Ored) est couplée à la réduction d’un couple rédox (Rox / Rred), avec échange de 3 électrons. Ecrire les 2 demi réactions rédox. |
|
Q5. Calculer ΔG°’couplage de la réaction globale précédente (question Q4). |
Données : T = 37°C ; R = 8,31 J.K-1.mol-1 ; F = 96500 J.V-1.mol-1 ; E°’couple R = - 0,16 V ; E°’couple O = - 0,17 V ; E°’(1/2 O2 / H2O) = + 0,82 V ; E°’(NAD+ / NADH + H+) = - 0,32 V ; ΔG°'synthèse ATP = + 30,3 kJ.mol-1 |
Exercice n°3 (10 points)
L’adénosine 5’-phosphosulfate kinase incorpore du sulfate dans les molécules organiques. On étudie la réaction qu’elle catalyse à partir d’ADP et de 3’-phosphate-5’-phosphosulfate ou PAPS. Les valeurs des vitesses initiales, en unités arbitraires (UA) pour différentes concentrations d’ADP et de PAPS, sont les suivantes :
| [PAPS] (µM) | ||||
| ADP (mM) | 3,2 | 5,12 | 10,24 | 192 |
| 0,33 | 0,017 | 0,025 | 0,042 | 0,117 |
| 0,5 | 0,021 | 0,030 | 0,049 | 0,119 |
| 1 | 0,027 | 0,038 | 0,059 | 0,122 |
| 5 | 0,034 | 0,047 | 0,070 | 0,124 |
Le graphe primaire pour l’un des deux substrats est fourni (ci-dessous) :
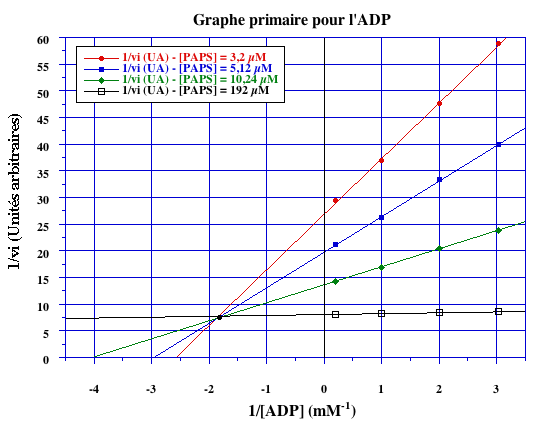
- 1. Tracer l’autre graphe primaire à l'aide de la représentation des doubles inverses.
- 2. En fonction du mécanisme, tracer le ou les graphe(s) secondaire(s) à l'aide de la représentation des doubles inverses.
- 3. Déterminer les valeurs de KD pour chaque substrat.
- 4. Déterminer les valeurs de KM pour chaque substrat.
- 5. Déterminer la valeur de VMax.
- 6. On admet que les unités arbitraires sont des unités d’absorbance.min-1. Calculer VMax en µM.min-1 et kcat en s-1.
- 7. L’iso-PAPS est un inhibiteur in-compétitif de l’ADP. Ecrire le schéma catalytique complet (substrat, inhibiteur) du mécanisme de cette réaction en précisant le type de mécanisme.
Données: [E0] = 35 nM - εMproduit = 1600 M-1.cm-1 = 1 cm