Exercice n°1 (5 points)
| A1. Paradoxalement, un inhibiteur incompétitif est d’autant plus efficace que la concentration du substrat est élevée. |
| A2. La synthèse d’ATP au cours de la respiration et au cours de la photosynthèse mette en jeu le même mécanisme (gradient de protons et ATP synthase). |
| A3. Kcat est une constante de vitesse du 1er ordre. |
| A4. C’est le changement de conformation de certaines sous-unités de l’ATP synthase qui permet le relarguage de l’ATP nouvellement synthétisé. |
| A5. Si Keq = 1, T = 37°C, R = 8,31 J.mol-1.K-1, alors ΔG°’ = 0 kJ/mol. |
| A6. Une voie métabolique va de la réaction [A -> B] vers la réaction [Y -> Z]. Le produit B peut inhiber la réaction [Y -> Z] et le substrat Y peut activer la réaction [A --> B]. |
|
A7. « 20 distinct transport functions are involved in the fluxes of the various metabolites through the inner mitochondrial membrane, which is the only mitochondrial permeability barrier, the outer membrane being freely permeable to molecules up to 5 kDa. » Conclusion : ADP et ATP franchissent la membrane externe par diffusion simple. |
| A8. Le produit d’une réaction a une énergie libre de Gibbs plus élevée que celle du substrat dont il émane. |
| A9. La synthèse d’une molécule d’ATP par l’ATP synthase est associée au retour de 9 protons. |
| A10. Une enzyme ne peut pas accélérer la vitesse d’une réaction plus de 100.000 fois. |
Exercice n°2 (2 points)
|
Une enzyme catalyse la réaction : 2A + B + C <=> D + 2E. In vivo, les concentrations physiologiques (φ) des métabolites sont : [A]φ = 1 µM - [B]φ = 1 mM - [C]φ = 9 10-3 M - [D]φ = 1 pM - [E]φ = 3 mM. Calculer la valeur de la constante physiologique Kφ ? |
Exercice n°3 (4 points). Répondre de manière claire et simple par quelques mots-clés.
|
« The ADP/ATP carrier transports ADP into the mitochondrial matrix and exports ATP toward the cytosol after its synthesis. The only physiological substrates are ADP and ATP, surprisingly, in their free forms, i.e., Mg-ADP and Mg-ATP are not recognized by the carrier. The ADP/ATP exchange is electrogenic, which means one negative charge is extruded from the matrix to the cytosol for each cycle, and this process is driven by the membrane potential. » Source : Nury et al. (2006) « Relations Between Structure and Function of the Mitochondrial ADP/ATP Carrier » Annu. Rev. Biochem. 75, 713 - 741 |
| Q1. Combien de charge(s) entrent dans la mitochondrie ? |
| Q2. Combien de charge(s) en sortent ? |
|
Q3. Calculer la valeur de la constante d’équilibre d’une réaction sachant que ΔG°’ = - 30,3 kJ.mol-1. Le détail du calcul n’est pas demandé. T = 37°C ; R = 8,31 J.mol-1.K-1 |
| Q4. Quel type de liaison est caractérisée par une valeur ΔG°’hydrolyse = - 30,3 kJ.mol-1 ? |
Exercice n°4 (9 points)
La nucléoside diphosphate kinase (NDPK) catalyse le transfert d'un groupement phosphoryle d'un nucléoside triphosphate (XTP) sur un nucléoside diphosphate (YDP) : XTP + YDP <=> XDP + YTP
a. Les valeurs des vitesses initiales de phosphorylation de CDP par ATP (en nM.min-1) sont les suivantes :
| ----- | [CDP] (mM) | |||
| [ATP-Mg2-] (mM) | 1 | 1,5 | 2 | 4 |
| 0,08 | 22 | 23,5 | 24,2 | 25,5 |
| 0,16 | 31,4 | 34,7 | 36 | 39 |
| 0,24 | 36,6 | 40,7 | 43 | 47 |
b. Les graphes primaires pour les deux substrats sont les suivants.
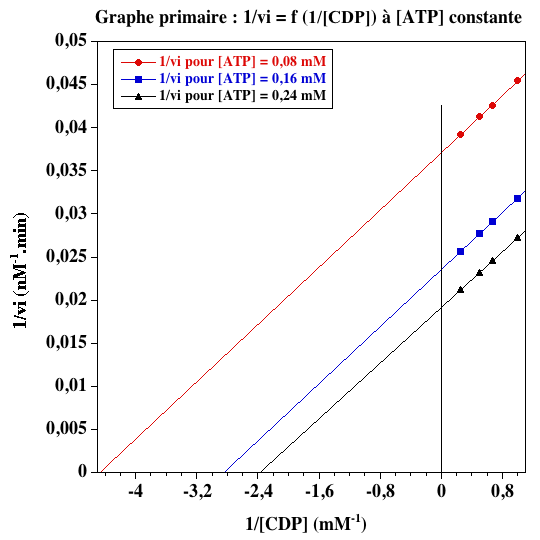
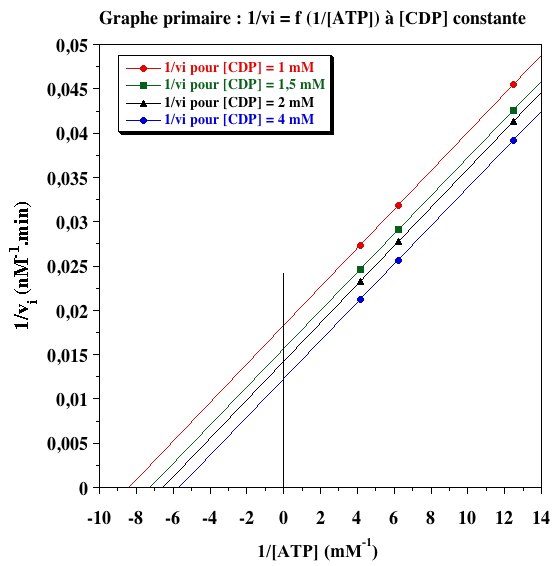
c. Les valeurs de Vmax obtenues à partir des graphes primaires sont les suivantes :
| [CDP] (mM) | Vmax[CDP]fixe | [ATP] (mM) | Vmax[ATP]fixe | |
| 1 | 55,6 | 0,08 | 27 | |
| 1,5 | 62,5 | 0,16 | 41,7 | |
| 2 | 71,4 | 0,24 | 52,6 | |
| 4 | 83,3 | ------ | ------ |
1. Tracez les graphes secondaires à l'aide de la représentation des doubles inverses.
2. Déterminez les valeurs de Vmax et les valeurs de KMCDP et de KMATP.
3. Ecrire le schéma catalytique. (1 point)
| Réponses courtes (mots-clé) OU entourer la réponse correcte (2 points). |
| Quel est le type de mécanisme à deux substrats de cette réaction ? |
| Citer un autre type de mécanisme à deux substrats. |
| Mécanisme ping-pong : le produit correspondant à l’un des substrats est un inhibiteur compétitif de l’autre substrat car il se fixe sur la même forme d’enzyme que ce substrat. L’ADP est-il compétitif du CDP ? |
| Après fixation de XTP et relarguage de XDP, la forme activée de l’enzyme est : NDPK - acide aminé - groupement phosphoryle. Quel est cet acide aminé : Phe ou His ou Asp ou Ile ? |