Les trois groupements phosphate contigus
chargés négativement constitue une disposition instable
et riche en énergie potentielle.
L'hydrolyse de l'ATP est donc exergonique car, en premier lieu elle diminue la répulsion électrostatique entre les atomes d'oxygène chargés négativement des
groupes phosphate de l'ATP.
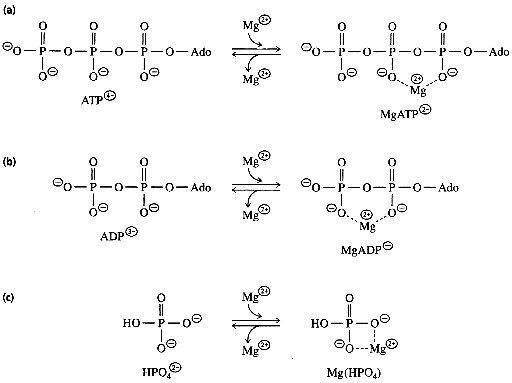
Source
: "Principes de Biochimie" Horton et al. (1994) Ed. DeBoeck Universités
1. Cette répulsion électrostatique dépend du pH :
- les pKa des fonctions ionisables de l'ATP et
des produits de son hydrolyse (ADP ou AMP) sont de 6 et de 7.
- ainsi, à des pH plus élevés
ou égaux à ces valeurs de pKa, une majeure partie de ces
groupes sont dissociés donc ionisés, ce qui augmente la
répulsion électrostatique, donc favorise la réaction
dans le sens de l'hydrolyse de l'ATP.
2. Cependant, dans la cellule, cette répulsion
électrostatique est minimisée par le magnésium :
- en effet, l'ATP et l'ADP existent dans la cellule
sous forme d'un complexe avec l'ion Mg2+.
- les charges positives portées par l'ion
Mg2+ ont pour effet de partiellement neutraliser les charges
négatives de l'oxygène, ce qui minimise cette fois la
répulsion électrostatique.
- en conséquence, le complexe ATP-Mg2+ est plus stable que la forme libre de l'ATP, la forme complexée
qui existe dans la cellule est donc moins facilement sujette à
l'hydrolyse.
Voir un cours de bioénergétique. |

