Le photon est un grain d'énergie qui se déplace à la vitesse de la lumière (v = c) avec une fréquence d'oscillation ν.
Son énergie est : Ephoton = hν = hc / λ (h est la constante de Planck = 6,626.10-34 J.s et λ est la longueur d'onde).
En spectroscopie ultraviolet / visible, on observe ce qui se passe lorsque certains groupements chimiques absorbent une partie de l'énergie d'un photon.
Pour qu'il y ait absorption, il faut que le photon ait une énergie égale à l'énergie de transition des électrons impliqués dans la liaison chimique du groupement en jeu.
- soit : E01 = énergie de l'atome au repos dans l'état fondamental (avant interaction avec le photon)
- soit : E02 = énergie de l'atome au repos dans l'état excité (après interaction avec le photon)
- alors : ΔE12 = hn12 = E02 - E01 est l'énergie de la transition entre l'état excité et l'état fondamental
Il faut donc que : ΔE12 = Ephoton = hc / λ
Celà signifie que seuls les photons ayant une longeur d'onde donnée seront absorbés.
Une liaison simple, ne possédant que des électrons s, absorbe la lumière dans l'ultraviolet lointain au-dessous de 200 nm. Dans cette région, il est presque impossible d'effectuer des mesures correctes et précises, simplement à cause du grand nombre de liaisons qui absorbent.
Dans la région de 200 à 400 nm on observe surtout les électrons π délocalisés et les doublets libres des atomes comme O et N.
Le pic d'un spectre d'absorbance est caractérisé par sa longueur d'onde, λ, exprimée en nm et son intensité caractérisée par son coefficient d'extinction molaire, εM.
Pour les solutions diluées, on peut évaluer la valeur de εM par la loi de Beer-Lambert : A = εM . l . C
- A : absorbance de la solution (sans dimension)
- l : longueur du trajet optique (cm)
- εM : coefficient d'extinction molaire (M-1.cm-1)
- C : concentration de la solution (M)
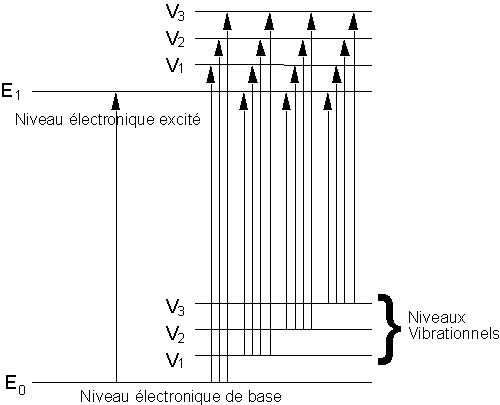
De plus, à cause des transitions impliquant les divers niveaux vibrationnels, les spectres ultraviolet et visible présentent des bandes larges et non des pics étroits comme en RMN.
Les spectres ultraviolet et visible révèlent l'étendue de la conjugaison des molécules organiques : la présence de doubles liaisons conjuguées augmente la valeur de εM.
Source : Notes de cours Chimie Organique (Sylvain Robert)