La souche utilisée, B834(DE3)pLysS, est un dérivé lysogène de la souche classique Escherichia coli B, c'est-à-dire qu'elle contient le prophage λ DE3 dont l'un des gènes code l'ARN polymérase du bactériophage T7.
La souche B834 est une souche parentale de la souche BL2, auxotrophe pour la méthionine.
Ce gène est sous le contrôle du promoteur lacUV5 inductible par l'isopropyl β-D-1-thiogalactopyranoside (IPTG). Ainsi, quand ces souches sont transformées par un vecteur d'expression (comme ceux de la famille pET) qui contient un promoteur fort (celui du bactériophage T7), la synthèse d'ARNm est accrue et la synthèse de la protéine d'intérêt peut atteindre une proportion de 40% à 50% des protéines totales.
Cependant, dans le cas de promoteurs forts, il y a une expression de base en absence d'inducteur. Cette "fuite" peut avoir 2 conséquences :
- une instabilité du vecteur et son éventuelle expulsion de la cellule hôte
- une teneur élevée en ARNm qui peut détruire les ribosomes et donc tuer la cellule hôte, avant l'induction de l'expression de la protéine recombinante
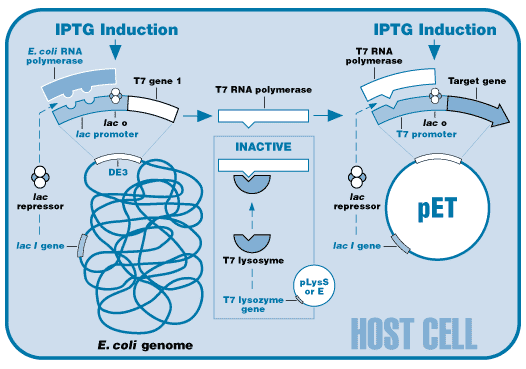
L'une des stratégies adoptées pour palier à ces problèmes est la co-sur-expression du lysozyme du bactériophage T7, dont le gène est porté par un plasmide additionnel, pLysS. En effet, le lysozyme est un inhibiteur de l'ARN polymérase du bactériophage T7, ce qui diminue le niveau de base de la transcription.
Une autre caractéristique importante de cette souche (et de toute souche dérivée de BL21) est qu'elle ne possède pas les gènes ompT et lon qui codent pour des protéases qui dégraderaient la protéine sur-exprimée.