1ère incorporation de NH3 : synthèse du glutamate catalysée par la glutamate déshydrogénase
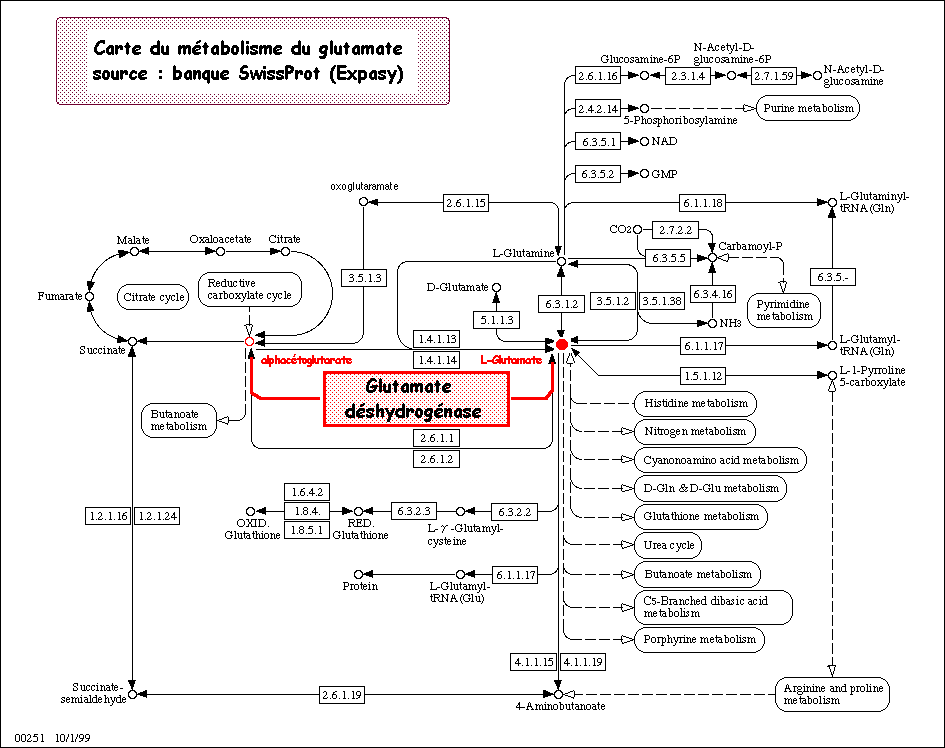
On peut considérer la première réaction d'assimilation de l'azote (sous forme d'ammoniac) par la glutamate déshydrogénase (GDH) comme point d'entrée dans ce métabolisme.
L'atome d'azote est à l'origine de la fonction α-aminée des acides aminés selon la réaction :
NH3+ + α-cétoglutarate + NAD(P)H + H+ <=> glutamate + NAD(P)+
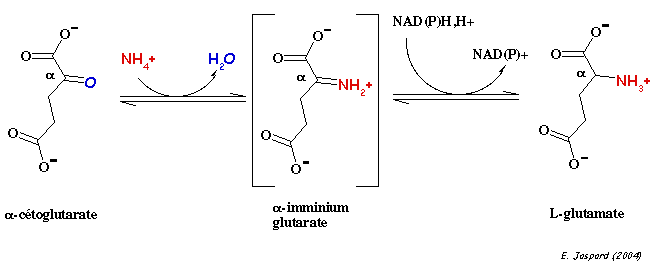
Au pH physiologique, l'ammoniac est sous forme NH4+ en solution (pKa = 9,2). Mais au centre catalytique de la GDH, c'est la forme déprotonnée NH3 nucléophile qui est l'espèce réactionnelle.
Il existe trois isoformes de GDH :
- la GDH EC 1.4.1.2 qui catalyse la réaction ésamination essentiellement ;
- la GDH EC 1.4.1.3 qui catalyse la réaction
- la GDH EC 1.4.1.4 qui catalyse la réaction dans le sens de formation du glutamate.
La GDH EC 1.4.1.4 est le sujet d'étude car cette isoforme n'est que peu caractérisée chez les végétaux.
Son étude ouvre de larges perspectives sur le mode de contrôle du métabolisme azoté via la régulation de l'activité enzymatique de la GDH qui est une enzyme multimérique à régulation allostérique.