Université d'Angers - Module S4BG4 - Bioénergétique & Enzymologie - Mai 2010
Exercice n°1 (4 points)
|
A1. Si Keq < 1, alors ∆G0’ > 0 J.mol-1.
|
VRAI |
|
A2. L'hypothèse "clé-serrure" est suffisante pour rendre compte de toutes les propriétés catalytiques des enzymes.
|
FAUX
|
|
A3. Le nombre de molécules d'ATP synthétisées est indépendant du type de navette employé pour faire entrer le pouvoir réducteur du [NADH + H+] dans la mitochondrie.
|
FAUX |
|
A4. Une enzyme efficace diminue l'énergie libre de Gibbs de la réaction qu'elle catalyse.
|
FAUX |
Exercice n°2 (6 points)
|
Q1. Comment s'appelle le mécanisme de synthese d'ATP au cours de la glycolyse ?
|
Phosphorylation au niveau du substrat |
|
Q2. Citer les deux grands types chimiques de mécanismes catalytiques.
|
Catalyse acide - base / Catalyse par covalence
|
|
Q3. Quel type d'inhibition se traduit par une augmentation de KM et une VM inchangée ?
|
Compétitive |
|
Q4. Quelle est la différence du point de vue du mécanisme entre un inhibiteur et un inactivateur ?
|
Fixation réversible / fixation irréversible |
|
Q5. Formule qui relie la variation d'énergie libre de Gibbs standard et la différence de potentiel de réduction standard ?
|
∆G0’ = - N . F . ∆E0’
|
|
Q6. Citer deux facteurs qui augmentent la vitesse de catalyse par les enzymes.
|
Effet de voisinage / Stabilisation de l'état de transition [réponse moins adaptée : Concentration E ou S - chaleur - pH]
|
Exercice n°3 (10 points)
|
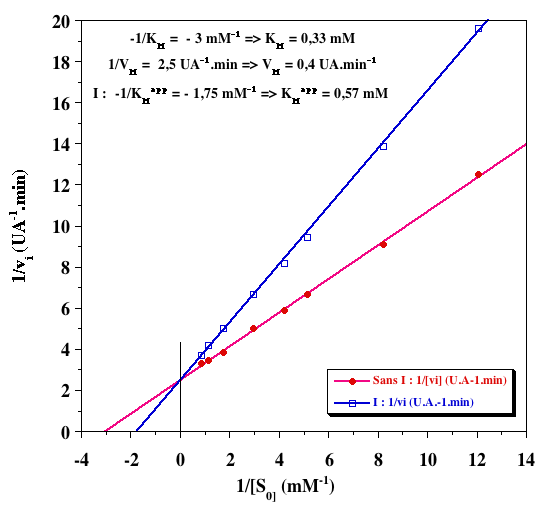
Paramètres
|
Sans I
|
Avec I
|
|
1/VM ou 1/VMapp (UA-1.min ) |
2,5
|
2,5
|
|
VM ou VMapp (µM.min-1) ou (M.s-1) |
23,5 ou 3,9 10-7 |
23,5 ou 3,9 10-7 |
|
kcat (min-1) ou (s-1) |
3,2 106 ou 53653 |
-----
|
|
-1/KM ou -1/KMapp (mM-1) |
- 3
|
- 1,75
|
|
KM ou KMapp (mM) |
0,33
|
0,57
|
|
Type inhibition
|
-----
|
Compétitive
|
|
KI (µM)
|
-----
|
7,6
|