Si le produit
d'une réaction enzymatique possède une propriété
physico-chimique qui permet de le quantifier au fur et à mesure
qu'il est formé, on peut suivre sa cinétique de formation :
- un enregistrement continu (les lignes) si l'appareil
de mesure est relié à un enregistreur
- des mesures discrètes (les points) qui,
reliées, donnent le même tracé
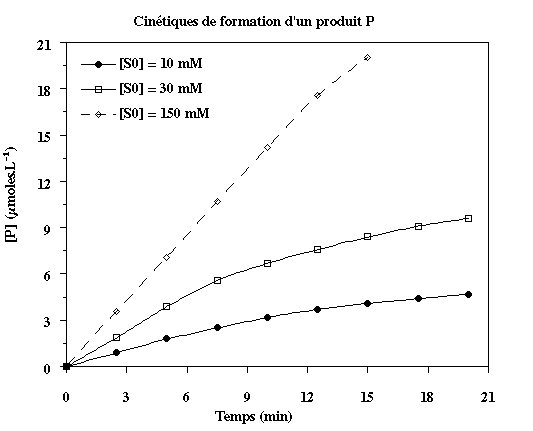
Figure ci-dessous :
- 3 cinétiques
obtenues pour des concentrations initiales d'un substrat de 10, 30 et
150 mM, respectivement.
- L'amortissement en fin de cinétique résulte
de la disparition
du substrat voire de l'accumulation du produit et, en conséquence,
de la diminution de la vitesse de la réaction enzymatique.
- Dans la grande majorité des cas, la formation
du produit est un phénomène exponentiel d'où la forme
des cinétiques enzymatiques.
Voir le cours complet sur la cinétique enzymatique. |

