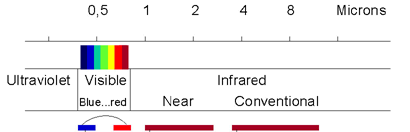
En spectroscopie infrarouge, on n'observe pas la transition des électrons comme dans le cas de la spectroscopie ulraviolet / visible, mais l'énergie associée à la vibration des liaisons chimiques.
Source : "Principes de la spectroscopie proche IR"
En effet, quand on soumet une molécule à une radiation infrarouge, la structure moléculaire se met à vibrer. Ceci à pour effet de modifier :
- les distances interatomiques : vibrations de valence ou d'élongation
- les angles de valence : vibrations de déformation
En spectroscopie infrarouge, on effectue donc un balayage de fréquence (comprises entre 4000 cm-1 et 625 cm-1).
L'usage veut que l'on caractérise un rayonnement infrarouge par le nombre d'onde en cm-1 (et non par sa longueur d'onde ou par sa fréquence).
Lorsque la fréquence de la radiation infrarouge est égale à la fréquence de résonance de la liaison, il y a absorption de l'énergie lumineuse et amplification des vibrations.
On peut montrer que la fréquence de vibration entre deux atomes dépend de la force de la liaison qui les unit et de leur masse atomique respective (m1 et m2) selon la loi de Hooke (qui décrit les mouvements d'un ressort) :
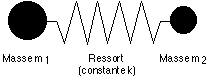
![]()
- ν = fréquence vibrationnelle en nombres d'ondes (cm-1)
- k = constante
- f = constante de force indiquant la force de la liaison entre les atomes
Chaque type de liaison possède une fréquence de vibration qui lui est propre. Le spectre infrarouge est donc extrêmement important pour l'identification de groupements chimiques.
| région | vibrations d'élongation |
| 4000 cm-1 à 2500 cm-1 | liaisons : N-H, C-H et O-H |
| 2500 cm-1 à 2000 cm-1 | triples liaisons |
| 2000 cm-1 à 1500 cm-1 | doubles liaisons : C=O, C=N et C=C |
| 2000 cm-1 à 1500 cm-1 | doubles liaisons : C=O, C=N et C=C |
| 1750 cm-1 à 1680 cm-1 | groupement carbonyle |
| 1680 cm-1 à 1640 cm-1 | bandes alcènes |
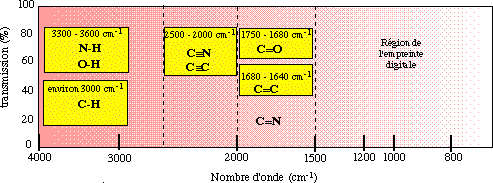
Source : Spectroscopie infrarouge
Les spectres infrarouge sont cependant très complexes et on ne peut attribuer toutes les bandes. On utilise les bandes principales, tant par leur présence que par leur absence.