Question n°1 (3 points) Répondre par vrai ou faux aux assertions suivantes.
| A1. La diminution d'insuline diminue les effets du glucagon. |
| A2. La sous-unité alpha des protéines G est une GTPase. |
| A3. Le domaine intracellulaire du récepteur de l’insuline est couplé à une protéine G. |
| A4. Le pli Rossmann fixe indifféremment NAD+ et NADP+. |
| A5. Avant de phosphoryler une autre protéine, une CaM-kinase II est sa propre cible. |
| A6. La protéine kinase A, l’AMPc et l’adénylate cyclase ont un lien. |
| A7. BLAST est un programme d’alignement global de séquences. |
| A8. Il faut 1 pli Rossmann pour fixer les 2 nucléotides du NAD(P)+. |
| A9. La séquence NFYALGKDS est fortement homologue à la séquence QWWIVGRET. |
| A10. Le motif [DN]-x-D-G-[DN]-G-[QTY]-x(4)-E est un site de fixation d’un anion. |
| A11. On dispose de plus de modèles de reconstruction métabolique à l’échelle d’un génome pour les Eucaryotes (notamment les plantes) que pour les Procaryotes. |
| A12. La sous-unité alpha des protéines G est ancrée dans la membrane. |
Question n°2 (4 points) Ecrire 8 mots-clé ou expressions-clé décrivant précisément la régulation du catabolisme du glucose.
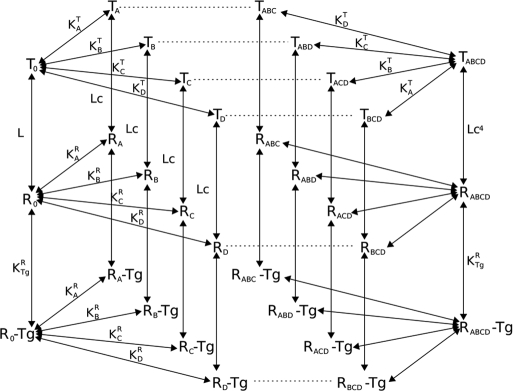
Question n°3 (6 points) Bien lire la figure, la légende et les questions avant de répondre.
|
Légende : - Tg = « Target » = protéine cible de la protéine étudiée - A, B, C, D : sites de fixation du ligand de la protéine étudiée - KRI et KTI : constantes de dissociation du ligand - RI : forme « activante » de la protéine étudiée |
| Que traduit le schéma ci-dessus ? |
| Combien de [formes / conformations] activantes de la protéine étudiée existe-t-il ? |
Combien de [formes / conformations] totales de la protéine étudiée existe-t-il ? |
Pourquoi n’y a-t-il pas la forme [T0-Tg] ? |
Comment s’appelle la constante L ? |
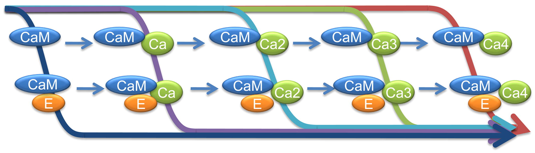
|
A quelle forme du 1er schéma correspond la forme « CaM-E » du schéma ci-dessus ? |
| A quelle forme du 1er schéma correspond « CaM-E-Ca4 » du schéma ci-dessus ? |
| Trouve-t-on autant de [formes / conformations] activantes potentielles de la protéine étudiée ? |
| Pourquoi ? |
De quelle protéine pourrait-il s’agir ? |
Question n°4 (4 points) : Donner une réponse courte et simple (mots-clé) aux questions suivantes.
| Q1. Quelle modification du glucose l’empêche de ressortir de la cellule ? |
Q2. Indiquez les positions [début - fin] des nucléotides susceptibles de correspondre à un siRNA : ATGATGGATT10GGAAAGGCAT20GCCTAGGCCC30TGCGTATGGA40TTGGTGA47 |
Q3. Qu’ont de particulier les siRNA en 3’ ? |
Q4. Ecrire la réaction catalysée par une protéine kinase. |
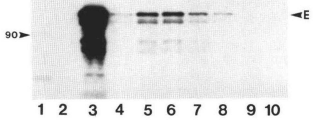
Q5. Ci-dessous le gel de Napoli et al. (1990).
|
Q6. Citez une base de données généraliste mondiale spécialisée dans les protéines. |
Q7. Les gènes codant les récepteurs membranaires sont remplacés par des gènes codant des protéines kinases aptes à phosphoryler toutes les cibles désirées à l’intérieur de la cellule. |
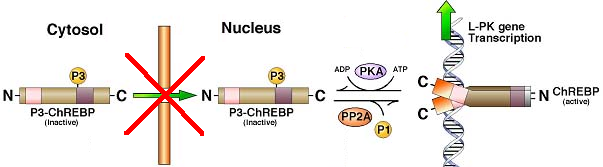
Q8. Quelle conséquence génétique aurait le phénomène traduit par la croix rouge dans la figure suivante ?
|
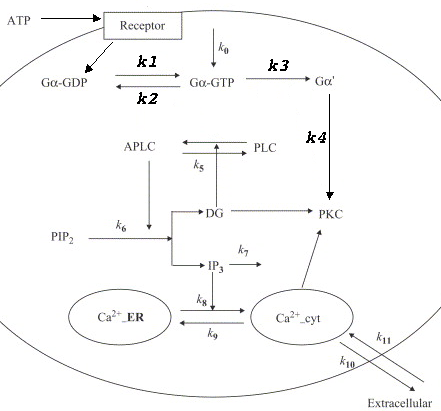
Question n°5 (3 points)
Ecrire la matrice de stœchiométrie S associée aux réactions régies par les constantes de vitesse k1, k2, k3 et k4 du schéma ci-contre. |
|
Donner une réponse courte et simple (mots-clé) aux questions suivantes.
| Q1. A quel type précis de récepteur correspond le récepteur ? |
Q2. Quel type précis de molécule permet la sortie du calcium (réactions 10 et 11) ? |
k0 |
| Q4. A quelle grande famille de molécules biologiques appartient l’inositol ? |