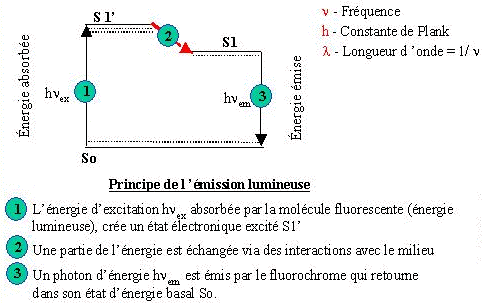
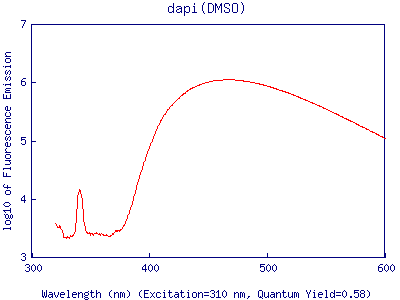
Pour une molécule complexe comme une protéine, les niveaux S0 et S'1 sont multiples, et il y a des pertes au sein de la molécule lors du retour d'un état excité S1' à un état excité S1 (exemple ci-contre).
En conséquence, l'énergie d'émission est toujours plus faible que l'énergie d'excitation. Ce qui se traduit par :
Eemission = h/lem < Eexcitation = h/lexc
La longueur d'onde de la lumiére d'émission est toujours plus élevée que celle de la lumiére d'excitation.
Source : "La microscopie confocale"