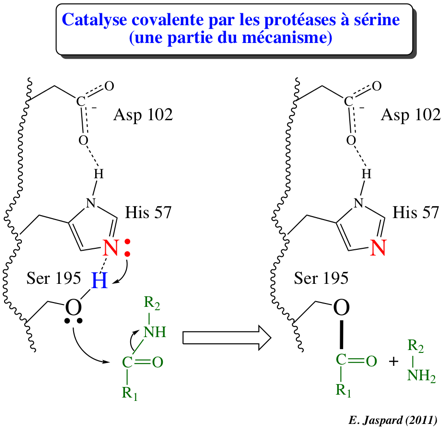
1. La catalyse acide base
Mécanisme trés courant dans les réactions enzymatiques :
- hydrolyse de la liaison peptidique (liaison ester de l'acyl-enzyme)
- réaction avec le groupement phosphoryle
- addition de groupement carbonyle
- ...
L'accélération de la réaction résulte du transfert d'un proton.
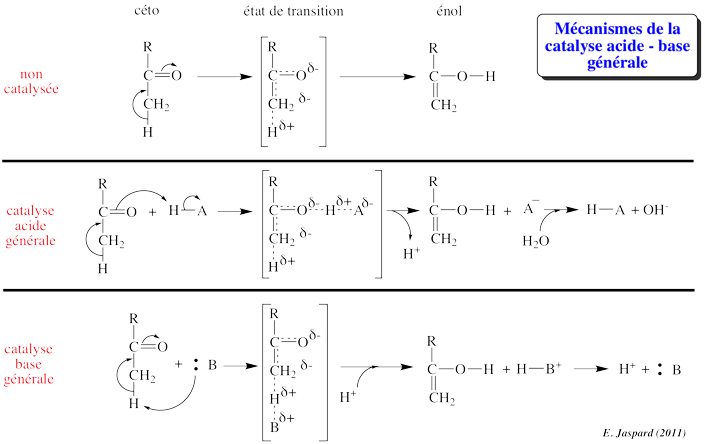
Par exemple, ce proton peut provenir du couple imidazole / imidazolium de la chaîne latérale de l'histidine puisqu'elle a un pKa situé entre 6 et 7 et constitue au pH physiologique un groupe donneur / accepteur de proton.
L'activité catalytique des enzymes de ce type est largement influencée par le pH.
Groupes fonctionnels des acides aminés qui peuvent agir en tant que catalyseur acide/base :
- groupement imidazole de His
- groupement α-aminé
- groupement α-carboxylique
- groupement thiol de Cys
- groupement carboxylique de la chaine latérale de Glu et Asp
- groupement ε-aminé de Lys
- groupement phénol de Tyr
- groupement guanidino de Arg