Il s'agit de la représentation :
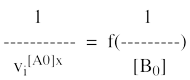
On a 3 cas de figure :
- α < 1 : la fixation du substrat B augmente l'affinité de l'enzyme pour le substrat A ; le point de concourrance des droites se situe au dessus de l'axe des abcisses (figure ci-dessus).
- α = 1 : la fixation du substrat B ne modifie pas l'affinité de l'enzyme pour le substrat A ; le point de concourrance des droites se situe sur l'axe des abcisses.
- α > 1 : la fixation du substrat B diminue l'affinité de l'enzyme pour le substrat A ; le point de concourrance des droites se situe au dessous de l'axe des abcisses.
Voir le cours sur les réactions enzymatiques à 2 (ou plus) substrats.