La cinétique de désactivation suit l'équation de Stern - Volmer :
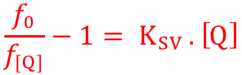
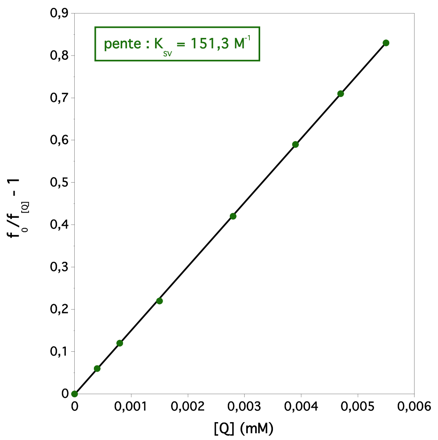
La représentation f0/f[Q] - 1 = f([Q]) est donc une droite de pente KSV.
- f0 : intensité de fluorescence en absence du désactivateur.
- f[Q] : intensité de fluorescence en présence du désactivateur à différentes concentrations [Q].
- KSV (constante de Stern - Volmer) = τ0 . kq
- τ0 : durée de vie de l'état excité émissif Mf* en absence du désactivateur.
- kq : constante de vitesse de la diffusion du désactivateur (taux de désactivation).