| Université d'Angers - Biochimie Métabolique - Septembre 2000 |
| Les liens hyper-texte renvoient vers les cours afférents aux notions abordées. |
| Répondre par vrai ou faux aux assertions 1 à 5. Donner la réponse aux questions 6 à 12. |
| 1. Quand une réaction est à l'équilibre, ΔG°' = 0. | FAUX |
| 2. Dans la cellule, les réactions catalysées par les kinases sont très souvent caractérisées par une variation d'énergie libre très négative. | VRAI |
| 3. Les réactions des voies métaboliques sont à l'état stationnaire. | VRAI |
| 4. La glycolyse génère plus de NAD réduit que le cycle de Krebs. | FAUX |
| 5. La synthèse de l'ATP par l'ATP synthase est couplée à un retour de protons contre leur gradient de concentration. | FAUX |
| 6. Citez un composé dont ΔG°'hydrolyse est plus négative que celle de l'ATP. | phosphoénolpyruvate ou 1,3 bisphosphoglycérate ou phosphocréatine ou phosphoarginine |
| 7. Si l'on compare l'ATP et le NAD, quelle est la partie propre à l'ATP (donc non commune avec le NAD) ? | groupement phosphoryle en position γ |
| 8. Citez une enzyme de la glycolyse qui catalyse une réaction au voisinage de l'équilibre dans la cellule. | toutes sauf gluco(hexo)kinase / phosphofructokinase / pyruvate kinase |
| 9. A quoi l'ATP est-il compléxé quand il intervient dans les réactions du métabolisme ? | au cation Mg2+ |
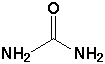
| 10. Formule développée de l'urée. |

|
|
11. La constante d'équilibre d'une réaction est égale à 10-2 M-1. Que vaut ΔG°' à 37°C ? |
ΔG°'
= - R . T . Ln Keq <=> ΔG°' = - 8,31 x 310 x Ln 10-2 <=> ΔG°' = + 11,86 kJ.mol-1 |
| 12. La réduction d'un couple rédox (Aox / Ared) est couplée à l'oxydation d'un couple rédox (Box/Bred), avec échange de 2 électrons. Que vaut ΔG°'couplage à 37°C ? |
ΔG°'
= - n . F . ΔE°'
<=> ΔG°' = - 2 x 96500 x [- 0,16 - (- 0,39)] <=> ΔG°' = - 44,39 kJ.mol-1 |
|
Données : R = 1,99 cal.K-1.mol-1 ou 8,31 J.K-1.mol-1 ; F = 23060 cal.V-1.mol-1 ou 96500 J.V-1.mol-1 ; E°'couple A = - 0,16 V ; E°'couple B = - 0,39 V |