- On remarque que quand la concentration de A augmente et celle de B augmentent, la vitesse initiale augmente : A et B sont deux substrats
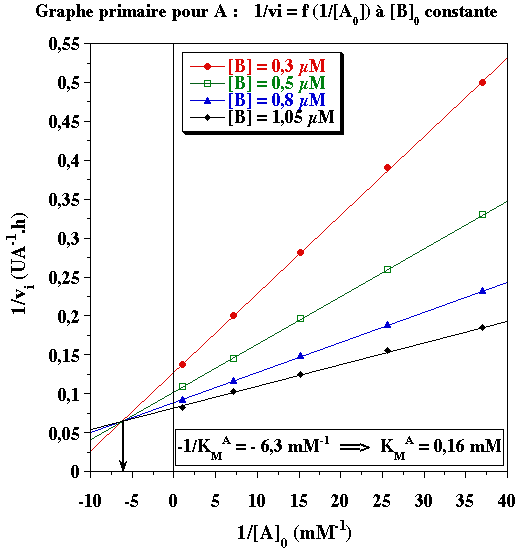
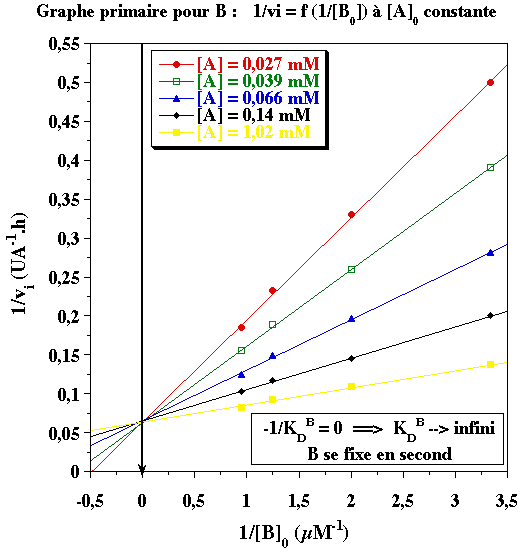
- Il s'agit d'un mécanisme ordonné : A se fixe en premier avec KMA = 0,16 mM
| Université d'Angers - Biochimie Métabolique - Septembre 2004 |
| Voir l'énoncé. |
Partie
A. Tracés graphiques et détermination des paramètres
cinétiques
|
|
Il n'y a pas de graphe secondaire pour A puisque B se fixe en second. A partir du graphe primaire pour B, on obtient les valeurs suivantes qui permettent de tracer le graphe secondaire pour B :
On trouve : VMax = 15,63 UA.h-1 D'après la relation de Beer - Lambert et avec εM = 16270 M-1.cm-1 et l = 1 cm : 15,63
VMax |
| Partie B. Schéma du mécanisme réactionnel tenant compte des molécules E, A, B, C et I et des différentes constantes déterminées |
| KMA | KMB | kcat | ||||
| E + A | <=> | EA + B | <=> | EAB | -> | E + P |
|
+ C |
+ I |
|||||
| EC | EAI |