a.
Association de l'acétylcholine à l'acétylcholinestérase
L'acétylcholinestérase est une hydrolase (EC 3.1.1.7) : acétylcholine + H2O <=> choline + acétate
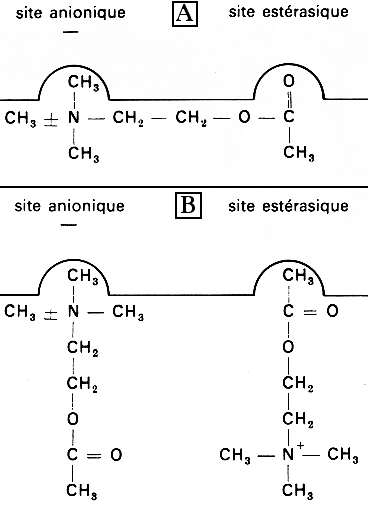
Il existe deux sous - sites de fixation
de l'acétylcholine, distants de 7 Å :
Source
: "Cinétique enzymatique
élémentaire et catalyse biochimique" J. Yon dans "Biochimie"(1974),
F. Chapeville & H. Clauser, Ed. Hermann
- le sous - site anionique qui porte une charge
négative et qui interagit avec la charge positive portée
par l'ammonium quaternaire du substrat.
- le sous - site estérasique (contenant
les résidus catalytiques sérine et histidine) et qui
interagit avec la liaison ester du substrat.
b. Inhibition par
excès de substrat : l'acétylcholine
- quand la concentration du substrat est faible,
chaque partie du substrat interagit avec le sous-site qui lui est
dédié.
- quand la concentration du substrat est forte,
une molécule de substrat n'interagit plus que partiellement
avec l'un ou l'autre des sous - sites, chaque sous - site étant
cependant occupé par une molécule de substrat.
Voir un cours sur l'inhibition des réactions enzymatiques. |

