Exercice n°1 (2 points)
| A1. Une valeur d'énergie libre de Gibbs standard nulle signifie que la réaction considérée est à l'équilibre. | FAUX |
| A2. Une réaction d'oxydo-réduction impliquant le couple (2H+/H2) se déroule dans le même sens à pH 1 et à pH 14. | FAUX |
| A3. L'hypothèse du quasi-équilibre stipule que : k-1 << kcat. | FAUX |
| A4. Le potentiel d'oxydo-réduction standard du couple (2H+/H2) est plus élevé à pH = 0 que dans la cellule. | VRAI |
Exercice n°2 (8 points)
|
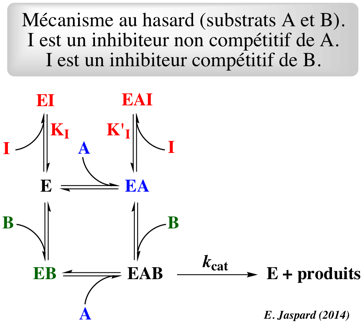
Q1. Ecrire le schéma réactionnel du système suivant :
|
|
|
Q2. Calculez la variation d’énergie libre de Gibbs standard dans les conditions physiologiques (ΔG°’) associée à la réoxydation du NAD réduit par l’oxygène moléculaire. |
ΔG°réoxydation = - 2 . F . ΔE°’ = - 2 x 96500 x [0,82 - (-0,32)] = - 220 kJ.mol-1 |
|
Q3. Calculez le nombre théorique de molécules d'ATP susceptibles d'être synthétisées avec la VEL Gibbs calculée ci-dessus (question Q2). |
n = 220 kJ.mol-1 / 30 kJ.mol-1 = 7 |
|
Q4. L’oxydation d’un couple rédox (Oox / Ored) est couplée à la réduction d’un couple rédox (Rox / Rred), avec échange de 3 électrons. Ecrire les 2 demi réactions rédox. |
Ored <==> Oox + 3 e- Rox + 3 e- <==> Rred |
|
Q5. Calculer ΔG°’couplage de la réaction globale précédente (question Q4). |
Exercice n°3 (10 points)
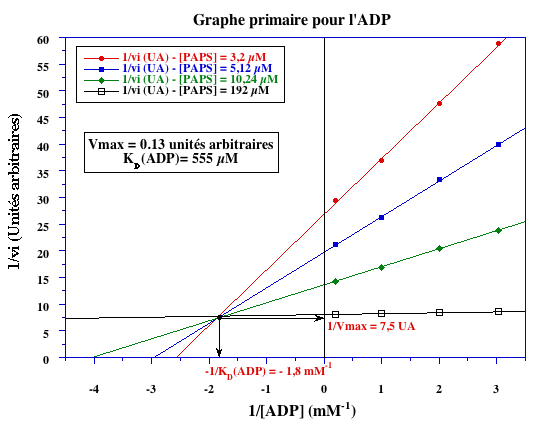
| Paramètres | ADP | PAPS |
|
VM (unités arbitraires) |
0,13 | 0,13 |
|
VM (ÁM.min-1) |
81,2 |
81,2 |
|
kcat (s-1) |
38,7 |
38,7 |
|
-1/KD (mM-1) |
- 1,8 | 0 |
|
KD (mM) |
0,56 | non déterminable |
| -1/KM (µM-1) | (- 1,8 mM-1) | - 0,125 |
| KM (ÁM) | (0,56 mM) | 8 |
Analyse du PAPS
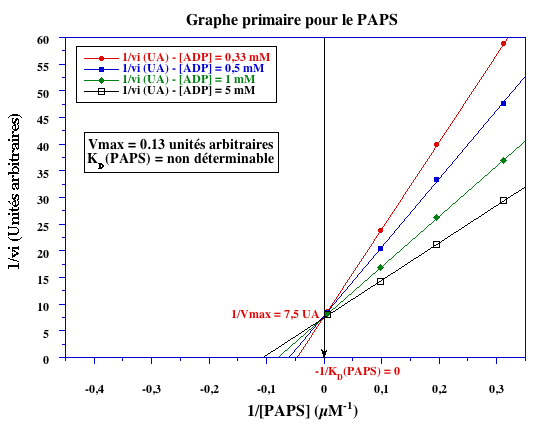
Analyse du PAPS
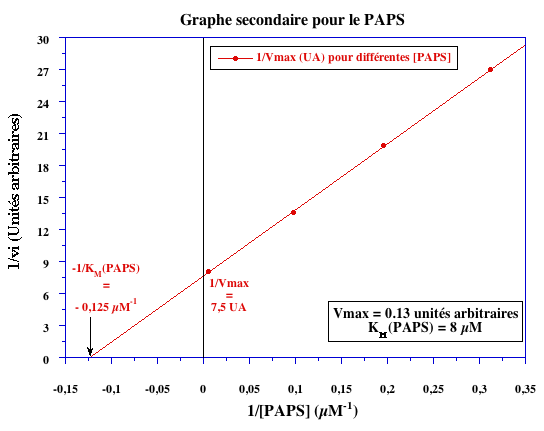
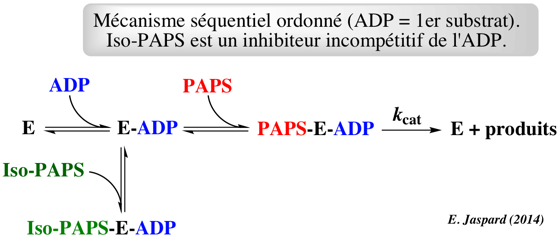
Schéma catalytique complet
Séquentiel ordonné avec ADP = premier substrat. L’iso-PAPS se fixe sur l’enzyme ayant déjà fixé l’ADP (inhibition incompétitive). |
|