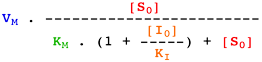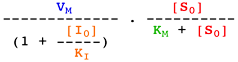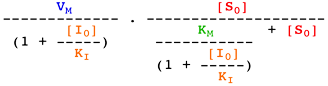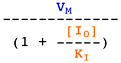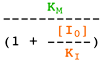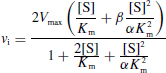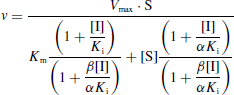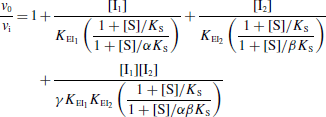1. Définition et caractéristiques générales des inhibiteurs
Toute molécule qui modifie la vitesse d'une réaction enzymatique est appelée un effecteur :
- Les effecteurs qui augmentent l'activité enzymatique sont des activateurs.
- A l'inverse, ceux qui la diminuent sont des inhibiteurs.
- Certaines molécules peuvent, selon les conditions, se comporter comme un activateur ou un inhibiteur.
La modulation (inhibition ou activation) de l'activité enzymatique est un mode de régulation primordial des voies métaboliques dans la cellule, d'autant que les inhibiteurs naturels sont multiples : antibiotiques, toxines, drogues, poisons ...
L'étude de l'effet d'inhibiteurs permet : (i) d'affiner le mécanisme catalytique d'une réaction enzymatique; (ii) de mieux connaître la spécificité d'une enzyme; (iii) d'obtenir des données physiques et chimiques concernant le site actif.
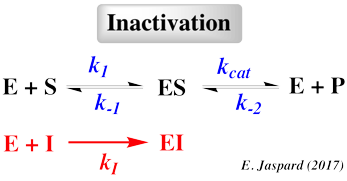
- En effet, certains inhibiteurs s'associent de manière réversible à l'enzyme en interagissant de manière non covalente.
- D'autres se fixent de manière IRréversible et sont souvent utilisés pour déterminer les groupes actifs du site catalytique.
Figure ci-dessous : illustration des mécanismes d'inhibition des protéases à sérine par différents composés qui forment un intermédiaire tétraédrique. Ces composés ont permis d'identifier la sérine 195 du site actif.
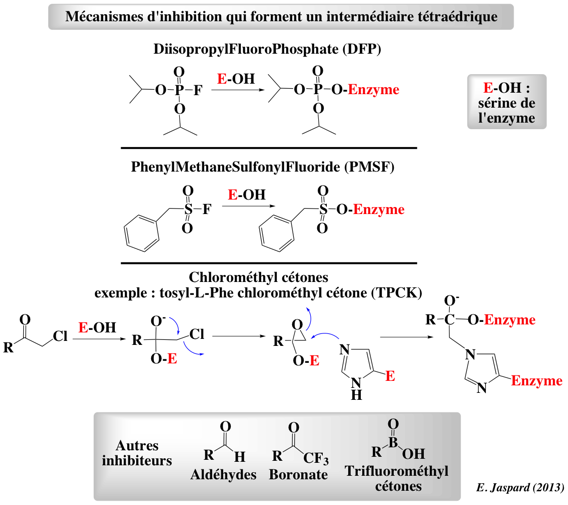
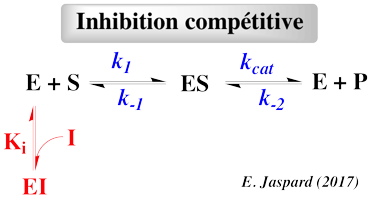
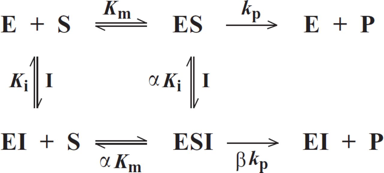
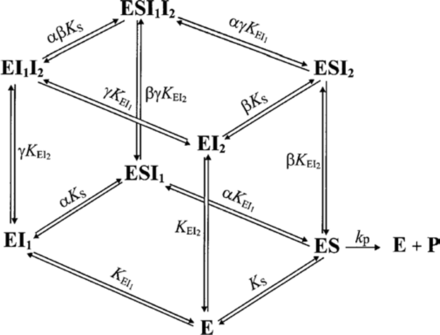
Selon le type d'inhibiteur, l'enzyme peut fixer :
- Le substrat ou l'inhibiteur : c'est la fixation exclusive avec formation des complexes binaires ES ou EI.
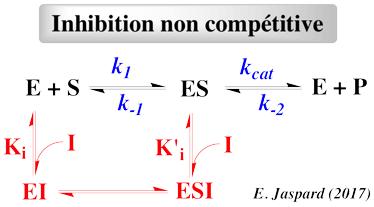
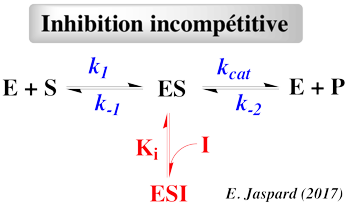
- Le substrat et l'inhibiteur :
- C'est la fixation non-exclusive avec formation d'un complexe ternaire additionnel ESI.
- Si ce complexe ternaire reste encore partiellement actif (c'est-à-dire moins que le complexe ES), l'inhibition est dite partielle et s'il est totalement inactif, l'inhibition est dite totale.
Voir un cours sur les équations élémentaires décrivant la vitesse des réactions enzymatiques.