Voir un cours sur les inhibitions des réactions enzymatiques.
Différents modèles de l'inhibition compétitive (fixation réversible exclusive)
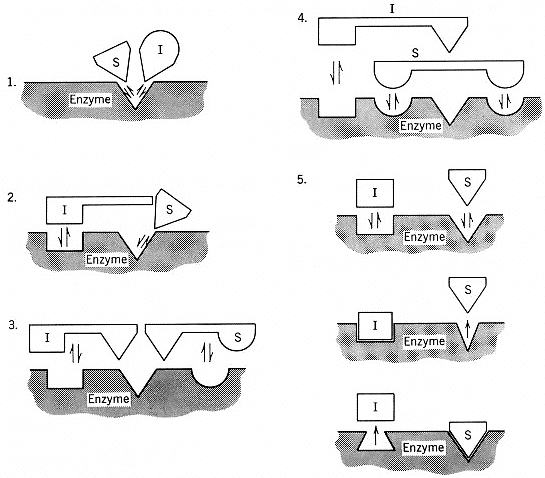
Source : "Enzyme Kinetics " I. Segel (1975), Ed. J. Wiley & Sons, Inc.
A. Modèle 1 (le plus simple) : le substrat et l'inhibiteur ont le même site de fixation => ils sont en compétition car ils ont une analogie de structure.
B. Les sites de fixation du substrat et de l'inhibiteur sont distincts :
- Modèle 2 : L'encombrement stérique de l'inhibiteur empêche la fixation du substrat.
- Modèle 3 : Le substrat et l'inhibiteur ont un groupe en commun qui se fixe à l'enzyme sur un 3è site de fixation.
- Modèle 4 : Les sites de fixation du substrat et de l'inhibiteur se recouvrent .
- Modèle 5 : La fixation de l'inhibiteur induit un changement de conformation de l'enzyme qui déforme ou masque le site de fixation du substrat (et inversement). Exemple des enzymes multimériques à régulation allostérique : l'aspartate transcarbamylase (voir ci-dessous), la glutamine synthétase ...
Exemples d'inhibiteurs compétitifs d'une protéase à sérine
La trypsine hydrolyse la liaison peptidique du côté carboxylique des résidus lysine et arginine et la chymotrypsine hydrolyse la liaison peptidique impliquant des résidus volumineux et hydrophobes comme le tryptophane.
La benzamidine (inhibiteur de la trypsine) et l'indole (inhibiteur de la chymotrypsine) sont des analogues structuraux de la chaîne latérale de l'arginine et du tryptophane, respectivement.
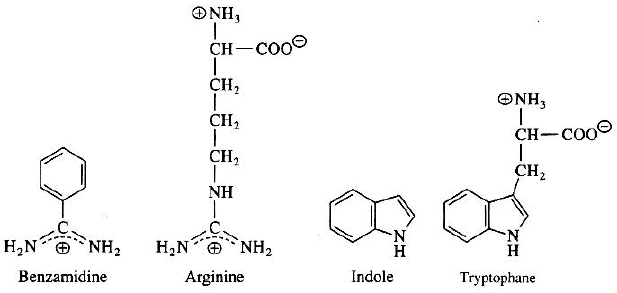
Source : "Principes de Biochimie" Horton et al. (1994), Ed. DeBoeck Universités
Rétro-inhibition de la voie de biosynthèse des pyrimidines
Voir un cours sur la biosynthèse des bases puriques, des bases pyrimidiques et des nucléotides.
L'aspartate transcarbamylase (ou ATCase, enzyme multimérique à régulation allostérique) est la première enzyme de la voie de biosynthèse des pyrimidines.
- Ses deux substrats sont l'aspartate et le carbamyl phosphate.
- La cytidine triphosphate (CTP, intermédiaire métabolique de cette voie) n'a aucune homologie structurale avec les deux substrats. Elle exerce cependant une rétro-inhibition de l'enzyme en se fixant sur un site qui lui est propre : un site allostérique.
- On remarque que l'adénosine triphosphate (ATP) est aussi un effecteur allostérique de l'ATCase, mais c'est un activateur.
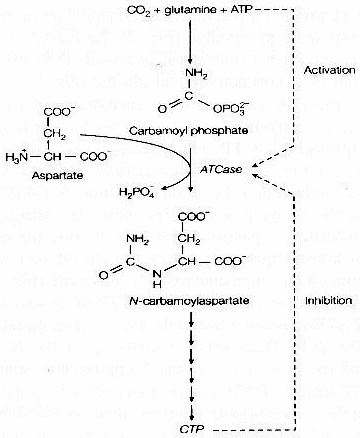
Source : "L'essentiel en Biochimie" Hames, Hooper & Houghton (2000), BERTI Editions
Régulation allostérique de l'ATCase
L'ATCase est l'archétype de l'enzyme sujette à régulation allostérique comme la phosphofructokinase 1.
La transition allostérique T <=> R correspond à :
- une diminution du volume du site actif de 1898 Å3 à 541 Å3
- une énergie d'activation de 13,0 ± 1,4 kcal.mol-1
Résumé des effecteurs allostériques :
- activation par les nucléotides de purines (niveau élevé d'ATP ou de dATP)
- inhibition par les nucléotides de pyrimidine : le CTP (le produit final de biosynthèse des pyrimidines) et le dCTP
- inhibition plus faible par le GTP, le dTTP et l'UTP
- le CTP et l'ATP décalent la courbe de saturation (coopérative) par l'aspartate vers la droite et vers la gauche, respectivement, sans modifier la vitesse maximale de l'enzyme
- l'activation de l'enzyme par l'ATP pourrait être réversée et complètement abolie par l'addition de CTP, ce qui suggère que les deux nucléotides sont en compétition pour le même site de fixation allostérique de l'enzyme
L'ATCase est aussi l'une des enzymes les plus étudiées sur le plan mécanistique : on suppose que la réaction se déroule via un intermédiaire tétraédrique. L'analogue structural de cet intermédiaire tétraédrique, le N-phosphonacétyl-L-aspartate (PALA) est un puissant inhibiteur de l'ATCase.
Le mécanisme réactionnel de la réaction catalysée par l'ATCase est un mécanisme Bi-Bi ordonné au cours duquel :
- le carbamyl phosphate se lie avant l'aspartate
- le produit N-carbamyl-L-aspartate quitte le site actif avant le phosphate inorganique
Nomenclature : carbamyl aspartate ou N-carbamyl-L-asparte ou acide uréido-succinique.