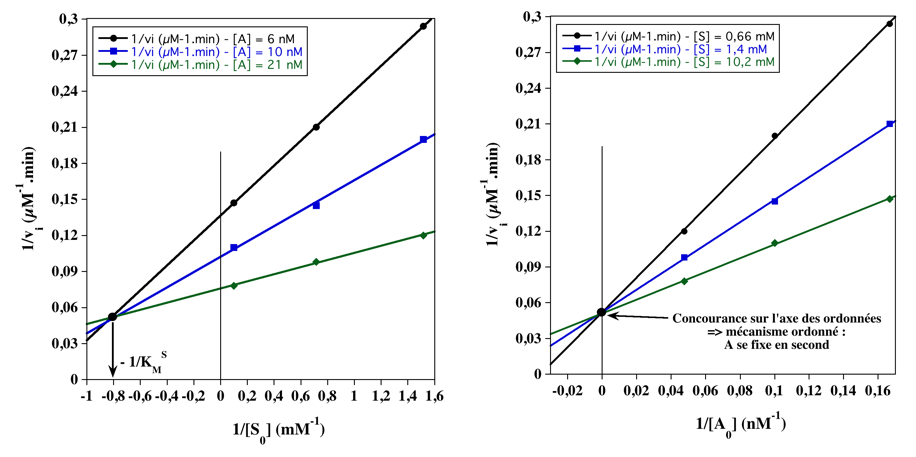
- Quand la concentration de S et/ou de A augmente, la vitesse initiale augmente : A est un second substrat.
- Les graphes primaires ci-dessous démontrent qu'il s'agit d'un mécanisme ordonné : S se fixe en 1er avec KMS = 1,25 mM.
| Université d'Angers - Biochimie Métabolique - Janvier 2003 |
| Voir l'énoncé. |
A. Graphes primaires pour S et A
|
| B. Vitesse
initiale de la réaction pour différentes
concentrations de S et de B (en présence d'une concentration
maintenue fixe de A)
Quand la concentration de B augmente, la vitesse initiale diminue : B est un inhibiteur.
*Exemple de conversion :
kcat = Vmax / [E0] = (8,1 10-4 M.min-1 / 9 10-6 M) = 90 min-1 => kcat = 1,5 s-1 Vmax diminue et KMS est inchangé en présence de l'inhibiteur B : il s'agit d'une inhibition non compétitive avec une constante d'inhibition KIB : VMaxapp . [B]0 |
| C. Schéma réactionnel |
| KMS kcat |
| E + S <=====> ES + A <=> ESA -------> E + P |
|
+B |
| EB + S <====> ESB + A <=> ESBA |