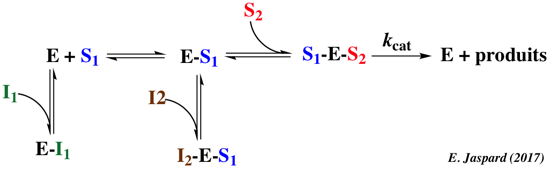
Ecrire le schéma réactionnel du système suivant.
- Un mécanisme ordonné à 2 substrats (S1 et S2). S1 est le 1er substrat.
- Un inhibiteur I1 compétitif de S1.
- Un inhibiteur I2 incompétitif de S1.
| Université d'Angers - Bioénergétique & Enzymologie - Session de Janvier 2017 |
|
Exercice n°1 (4 points) - Répondre par VRAI ou FAUX aux assertions suivantes. |
| Q1. L’ATP synthase transporte un soluté. | VRAI |
| Q2. L’ATP synthase est une enzyme. | VRAI |
| Q3. La perméase GLUT4 est une enzyme. | FAUX |
| Q4. L’ATPase [Na+/K+] (ou pompe [Na+/K+]) est une enzyme qui transporte un soluté. | VRAI |
| Q5. Si Keq = 1, T = 37°C, R = 8,31 J.mol-1.K-1, alors ΔG0’ = 0 kcal.mol-1. | VRAI |
| Q6. Le potentiel de membrane de l’axone du cachalot est de -120 volts. | FAUX |
| Q7. La concentration en enzyme double ([S0] reste saturant) : alors Vmax double. | VRAI |
| Q8. La pompe [Na+/K+] fonctionne "à l’envers" de l’ATP synthase mitochondriale. | VRAI |
| Q9. "20 distinct transport functions are involved in the fluxes of the various metabolites through the inner mitochondrial membrane, which is the only mitochondrial permeability barrier, the outer membrane being freely permeable to molecules up to 5 kDa." Conclusion 1 : ADP et ATP franchissent la membrane interne (« inner ») de la mitochondrie par diffusion simple. |
FAUX |
| Q10. Conclusion 2 : ADP et ATP franchissent la membrane interne de la mitochondrie par transport actif. | VRAI |
| Q11. L’étape d’acylation forme le premier intermédiaire tétrahèdrique au cours du mécanisme catalytique des protéases à sérine. | VRAI |
| Q12. La variation de la concentration des métabolites permet de contrôler le flux d’une voie métabolique. | FAUX |
| Q13. Le NAD+ n’absorbe pas à 340 nm. | VRAI |
| Q14. Les conditions d'étude des cinétiques enzymatiques in vitro ne reflètent pas la réalité cellulaire. | VRAI |
| Q15. Les conditions d'étude des cinétiques enzymatiques in vitro reflètent la réalité cellulaire. | FAUX |
| Q16. Un inhibiteur incompétitif est d’autant plus efficace que [S0] est élevée. | VRAI |
Exercice n°2 (2 points) |
Ecrire le schéma réactionnel du système suivant.
|
Exercice n°3 (2 points) |
Q1. Ecrire la réaction suivante dans le sens thermodynamiquement spontané : NADH + H+ + 1/2 O2 <=> NAD+ + H2O |
NADH + H+ + 1/2 O2 <=> NAD+ + H2O |
Q2. Calculez la variation d’énergie libre de Gibbs standard dans les conditions physiologiques de cette réaction. Aucun détail n’est demandé. |
ΔG0’ = - 220 kJ.mol-1 ΔG0’ = - 52,6 kcal.mol-1 |
| Données : E°’ (NAD+ / NADH) = - 0,32 V ; E°’ (1/2 O2 / H2O) = + 0,82 V / R = 1,987 cal.K-1.mol-1 = 8,31 J.K-1.mol-1 / F = 96485 J.V-1 = 23060 cal. V-1 / T = 37°C | |
Exercice n°4 (2 points). Réponses courtes (mots-clé) ou entourer la réponse correcte.
|
| Quel est le type de mécanisme catalytique ci-dessus ? | Mécanisme ordonné Ter Bi |
| Qu’est-ce que F ? | Une forme de l’enzyme |
| Sur quelle forme de l’enzyme se fixerait un inhibiteur compétitif du substrat C ? | F |
| Entourer l’ordre correct [entrée - sortie] des [substrats - produits] : ABPCQ / ABCPQ / APBCQ / APQBC | ABPCQ |
Exercice n°5 (10 points) |
| paramètres | sans I | I1 | I2 | I3 |
| -1/VM ou -1/VMapp (UA-1.min) | 0,61 | 1,20 | 0,61 | 1,20 |
| VM ou VMapp (µM.min-1) | 132,8 | 67,5 | 132,8 | 67,5 |
| kcat (s-1) | 22,1 | ----- | ----- | ----- |
| -1/KM ou -1/KMapp (mM-1) | - 0,099 | - 0,192 | - 0,048 | - 0,099 |
| KM ou KMapp (mM) | 10,1 | 5,21 | 20,8 | 10,1 |
| Type inhibition | ----- | incompétitive | compétitive | non compétitive |
| KI (µM) | ----- | 0,093 | 0,25 | 16,5 |
|