Le gel de chromatographie d'interactions hydrophobes porte un groupement hydrophobe tel qu'un noyau phénol à l'extrémité d'une chaîne carbonée. Les parties hachurées (figure ci-dessous) représentent les régions de caractère hydrophobe en surface de la protéine.
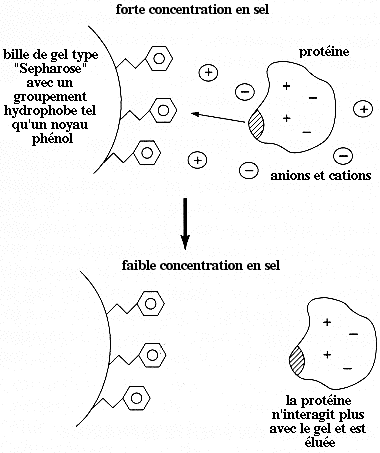
Figure inspirée de : "Strategies for Protein Purification and Characterization" Marshak et al. (1996) - Cold Spring Harbor Laboratory Press
1ère étape
- On fixe la protéine à séparer sur le support chromatographique en présence d'une forte concentration en sel.
- Dans un milieu à haute force ionique, les molécules d'eau de l'enveloppe d'hydratation des protéines sont mobilisées pour hydrater les anions et les cations issus de la dissociation du sel, c'est le phénomène de "salting -out".
- Il en résulte une modification de l'organisation des molécules d'eau autour des protéines et ce changement d'environnement est thermodynamiquement favorable à l'établissement d'interactions hydrophobes entre les régions hydrophobes à la surface des protéines et le groupement hydrophobe porté par la phase stationnaire.
2ème étape
- Après rinçage du gel afin d'éliminer les protéines non adsorbées, l'élution des protéines fixées est obtenue en faisant passer un tampon de force ionique décroissante, les ions du sel étant ainsi progressivement éliminés.
- Les acides aminés chargés ou polaires à la surface des protéines peuvent de nouveau établir des liaisons hydrogène avec la phase mobile, c'est-à-dire que la solubilité des protéines dans la phase mobile redevient maximale et elles sont éluées.