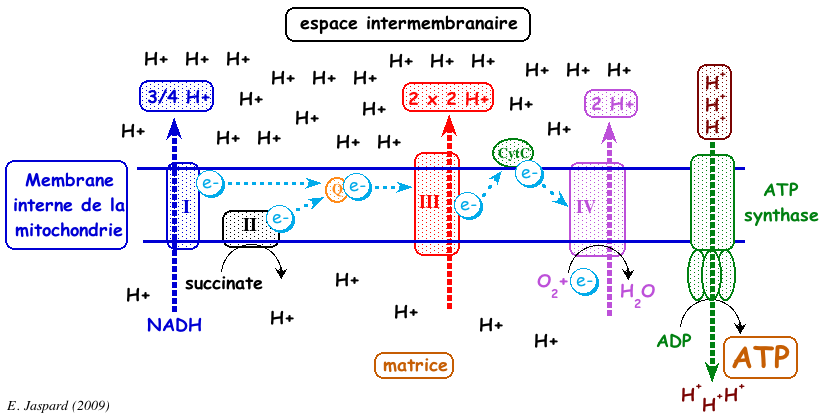
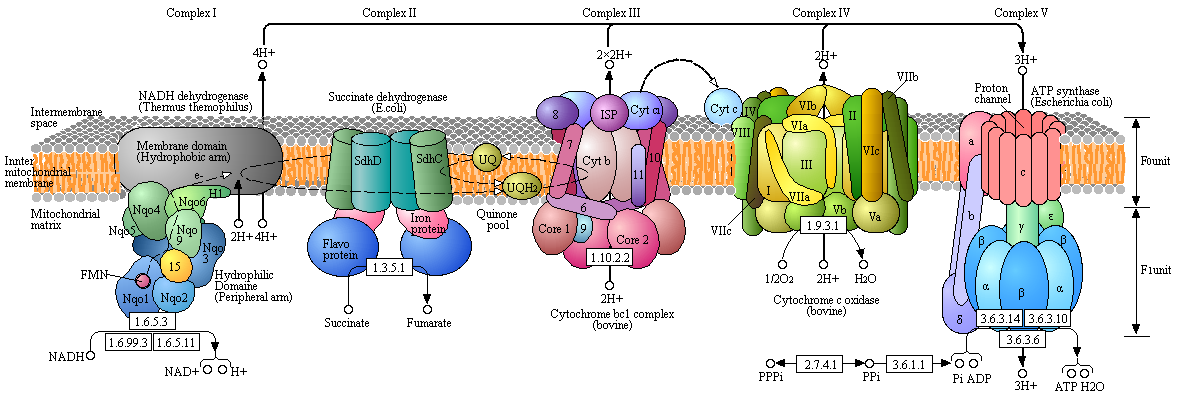
a. Calcul
de la variation de l'énergie libre de Gibbs standard de
la réoxydation du NADH
Les deux-demi réactions rédox sont :
- NADH + H+ <=> NAD+ + 2 H+ + 2 e-
- 1/2 O2 + 2 H+ + 2 e- <=> H2O
Réaction globale
: NADH + H+ + 1/2 O2 <=> NAD+ + H2O
Avec : E°'(NAD+/NADH)
= - 0,32 V et E°'(O2/H2O)
= + 0,82 V
Différence de potentiel rédox standard : ΔE°' = E°'(O2/H2O) - E°'(NAD+/NADH) = 0,82 - (-
0,32) = + 1,14 V
Donc : ΔG°'(réoxydation NADH) = - n . F . ΔE°' = - 2 x 96500 x 1,14 = - 216 kJ.mol-1
Voir un cours sur la variation d'énergie libre de
Gibbs dans les conditions standard. |