
| Bioremédiation de micropolluants |
| Tweet |
 |
|
1. La bioremédiation 2. La bioremédiation par les champignons 3. PAH oxydés par différentes espèces de champignons et leurs métabolites 4. Oxydation des PAH par différentes enzymes de champignons
5. Les fungi
|
6. Dégradation des dérivés du benzène et du phénol
7. Quelques molécules thérapeutiques polluantes
8. Développement de capteurs électrochimiques et d'une biopile fongique 9. Etude de composés phénoliques comme source de carbone : exemple du toluène 10. Liens Internet et références bibliographiques |
Ce projet de bioremédiation de résidus médicamenteux et de micropolluants dans l'environnement (les eaux usées) par un champignon est piloté par Maxime Pontié, Professeur en génie des procédés à l'Université d'Angers. Présentation du projet "biopile fongique" du 12 octobre au 25 novembre 2018 au Palais de la découverte (animation scientifique "1 chercheur.e, 1 manip"). Voir le document : "évaluation des risques sanitaires liés à la présence de résidus de médicaments dans les eaux destinées à la consommation humaine - méthode générale et application à la carbamazépine et à la danofloxacine". |
1. La bioremédiation La bioremédiation est une stratégie efficace pour biodégrader les contaminants organiques, tels que les hydrocarbones aromatiques polycycliques ("Polycyclic Aromatic Hydrocarbons" - PAH) qui sont des molécules à haut potentiel mutagène, cancérogène et reprotoxique (CMR) et certains composés pharmaceutiques.
Source : aus der Beek et al. (2016) Selon la directive européenne 93/67/CEE, les substances chimiques sont classées dans différentes classes de risque sur la base de la valeur la plus basse de leur EC50 :
Les PAH sont dans la liste des polluants organiques persistants et dans la liste des polluants prioritaires de l'agence de protection de l'environnement USA ("United States Environmental Protection Agency").
La bioremédiation utilise les processus biochimiques (le métabolisme) de microorganismes (algues, bactéries et champignons) pour transformer les contaminants (polluants) en substances inertes. Il existe un large éventail de processus de remédiation, par exemple :
Exemples d'autres traitements non biologiques : photodégradation, irradiations rayons gamma, traitement mécanique de boues déshydratées avec des films minces d'argent dopés, ... Exemples de domaines et de lieux où la bioremédiation a complètement dégradé les contaminants (Biswas et al., 2015) :
Electroremédiation Cette technique, utilisée principalement pour l'extraction des métaux lourds, applique le courant électrique pour engendrer le mouvement des contaminants. Cette technique, seule ou combinée à la technique Fenton ou à la bioremédiation donnent de bons résultats dans l'élimination des PAH (Qin et al. 2016). L'application séquentielle d'un agent chélatant (l'acide citrique) puis d'un agent tensio-actif au cours de l'électroremediation simultanée de sédiments contaminés par des métaux toxiques et les PAH a été étudiée (Hahladakis et al. 2014). L'acide citrique améliore de façon spectaculaire l'élimination de Zn et As. L'efficacité d'agents tensioactifs non ioniques (Poloxamer 407 et Nonidet P40) a été évaluée : ils éliminent 43% et 48% des PAH (exemple, le fluorène), respectivement. Ce résultat est meilleur que celui obtenu avec le Tween 80 (21%). |
2. La bioremédiation par les champignons ou remédiation fongique Les mécanismes d'élimination des composés PAH ou pharmaceutiques incluent :
L'élimination de certains composés par les cellules fongiques entières et par les enzymes purifiées ne sont pas équivalentes, ce qui souligne l'importance des effets synergiques entre les enzymes extracellulaires, liées au mycélium et intracellulaires. De plus, la sécrétion de médiateurs naturels contribue à augmenter la dégradation de ces composés. L'utilisation des champignons comme agents de bioremédiation fait l'objet de travaux de recherche du fait du potentiel de leurs enzymes oxydantes dans la transformation enzymatique de polluants dans l'environnement. C'est le cas notamment de champignons appartenant aux Ascomycètes (Ascomycota) et aux Zygomycètes (Zygomycota). De nombreux champignons lignino-lytiques (dégradation de la lignine par hydrolyse enzymatique) sont capables d'oxyder les PAH (Cerniglia, 1992). Les champignons lignino-lytiques (exemple : Irpex lacteus) oxydent la lignine par l'action des peroxydases de lignine, des peroxydases Mn-dépendantes et des laccases. Ces enzymes ont une spécificité large car elle oxydent une grande variété de composés organiques. Exemples :
Dans le traitement à l'échelle du laboratoire, les PAH de haut poids moléculaire sont plus significativement dégradés en 3 mois dans les microbiotes inoculés par Phanerochaete velutina que dans les microbiotes non inoculés : 96% des PAH à 4 cycles (vs. 55%) et 39% des PAH à 5 et 6 cycles (vs. 7%). Cependant, à l'échelle du champ, la dégradation est similaire (94% des PAH dégradés en 3 mois dans les deux cas). Dans l'expérience à l'échelle du champ, le nombre de copies du gène de la dioxygénase hydroxylante des PAH cycliques des bactéries Gram+ augmente d'un facteur 1000 : la dégradation bactérienne des PAH joue un rôle important. |
| 3. PAH oxydés par différentes espèces de champignons et leurs métabolites | ||||
| Composés | Microorganismes | Références | Métabolites | Références |
| Acenaphtène | Cunninghamella elegans | (Pothuluri et al., 1992a, 1992b) | 1-Acenaphthenone, 1,2-Acenaphthenedione, cis-1,2-Dihydroxyacenaphthene, trans-1,2-Dihydroxyacenaphthene, 1,5-Dihydroxyacenaphthene, 6-Hydroxyacenaphthenone |
(Pothuluri et al., 1992a, 1992b) |
| Anthracène | Bjerkandera sp., Cunninghamella elegans, Naematoloma frowardii, Phanerochaete chrysosporium, Phanerochaete laevis, Pleurotus ostreatus, Pleurotus sajor-caju, Ramaria sp., Rhizoctonia solani, Trametes versicolor |
(Bezalel et al., 1996a, 1996b, 1996c; Bogan and Lamar, 1995; Cerniglia and Yang, 1984; Hammel et al., 1992; Johannes and Majcherczyk, 2000; Kotterman et al., 1998; Sack and Günther, 1993) | Anthracene trans-1,2-Dihydrodiol 1-Anthrol, 9,10-Anthraquinone, Phthalate, Glucuronide, Sulfate and Xyloside conjugates of hydroxylated intermediates | (Bezalel et al., 1996a; Cerniglia, 1982; Cerniglia and Yang, 1984; Collins and Dobson, 1996; Field et al., 1992; Hammel et al., 1991; Johannes et al., 1996; Sutherland et al., 1992) |
| Phenanthrène | Aspergillus niger, Cunninghamella elegans, Naematoloma frowardii, Phanerochaete chrysosporium, Phanerochaete laevis, Pleurotus ostreatus, Syncephalastrum racemosum, Trametes versicolor |
(Bezalel et al., 1996a, 1996b, 1996c; Bogan and Lamar, 1996; Bumpus, 1989; Cerniglia, 1997a, 1997b; Hammel et al., 1992; Kotterman et al., 1998; Sack and Günther, 1993) | Phenanthrene trans-1,2-dihydrodiol Phenanthrene trans-3,4-dihydrodiol Phenanthrene trans-9,10-dihydrodiol Glucoside conjugate of 1-phenanthrol 1-,2-,3-,4-, and 9-phenanthrol 1-methoxyphenanthrene, Phenanthrene-9,10-quinone 2,2-Diphenic acid |
(Bezalel et al., 1996b; Casillas et al., 1996; Cerniglia et al., 1989; Cerniglia and Yang, 1984; Hammel et al., 1992; Sack et al., 1997a, 1997b; Sutherland et al., 1991) |
| Fluorène | Cunninghamella elegans, Laetiporus sulphureus, Phanerochaete chrysosporium, Pleurotus ostreatus, Trametes versicolor | (Bezalel et al., 1996a, 1996b, 1996c; Bogan et al., 1996a, 1996b; Bogan and Lamar, 1996; Sack and Günther, 1993) | 9-Fluorenone 9-Fluorenol 2-Hydroxy-9-fluorenone |
(Bezalel et al., 1996a; Bogan et al., 1996a, 1996b; Pothuluri et al., 1993) |
| Fluoranthene | Cunninghamella elegans, Naematoloma frowardii, Laetiporus sulphureus, Penicillium sp., Pleurotus ostreatus | (Sack and Günther, 1993) | Fluoranthene trans-2,3-dihydrodiol, 8 and 9-Hydroxyfluoranthene trans-2,3-dihydrodiols, Glucoside conjugates of hydroxylated intermediates |
(Pothuluri et al., 1992a, 1992b; Pothuluri et al., 1990) |
| Pyrene | Aspergillus niger, Agrocybe aegerita, Candida parapsilopsis, Crinipellis maxima, Crinipellis perniciosa, Crinipellis stipitaria, Crinipellis zonata, Cunninghamellaelegans, Fusarium oxysporum, Kuehneromyces mutablis, Marasmiellus ramealis, Marasmius rotula, Mucor sp., Naematoloma frowardii, Penicillium janczewskii, Penicillium janthinellum, Phanerochaete chrysosporium, Pleurotus ostreatus, Syncephalastrum racemosum, Trichoderma harzianum |
(Bezalel et al., 1996a, 1996b, 1996c; Hammel et al., 1986; Manilla-Pérez et al., 2011) | 1,6-Pyrenequinone 1,8-Pyrenequinone Glucoside conjugates 1-Pyrenol 1,6-dihydroxypyrene 1,8-dihydroxypyrene 1-Pyrene sulfate 1-Hydroxy-8-pyrenyl sulfate 6-Hydroxy-1-pyrenyl sulfate Pyrene trans-4,5-Dihydrodiol |
(Bezalel et al., 1996a; Cerniglia et al., 1986; Hammel et al., 1986; Lange et al., 1996; Launen et al., 1995; Sack et al., 1997a) |
| Benzo[a]anthracene | Candida krusei, Cunninghamella elegans, Phanerochaete chrysosporium Phanerochaete laevis, Pleurotus ostreatus, Rhodotorula minuta, Syncephalastrumracemosum, Trametes versicolor | (Bogan et al., 1996a, 1996b; Cerniglia, 1984) | Benz[a]anthracene trans-3,4-dihydrodiol, Benz[a]anthracene trans-8,9-dihydrodiol, Benz[a]anthracene trans-10,11-dihydrodiol, Phenolic and tetrahydroxy derivativesof benz[a]anthracene, Glucuronide and Sulfate conjugates of hydroxylated intermediates |
(Cerniglia et al., 1994; Cerniglia et al., 1980a, 1980b) |
| Benzo[a]pyrene | Aspergillus ochraceus, Bjerkandera adusta, Bjerkandera sp., Candida maltosa, Candida maltosa, Candida tropicalis, Chrysosporium pannorum, Cunninghamella elegans, Mortierella verrucosa, Naematoloma frowardii, Neurospora crassa, Penicillium janczewskii, Penicillium janthinellum, Phanerochaete chrysosporium, Phanerochaete laevis, Pleurotus ostreatus, Ramaria sp., Saccharomyces cerevisiae, Syncephalastrum racemosum, Trametes versicolor, Trichoderma sp., Trichoderma viride |
(Bezalel et al., 1996a, 1996b, 1996c; Bogan and Lamar, 1996; Bumpus et al., 1985; Haemmerli et al., 1986; Sack and Günther, 1993) | Benzo[a]pyrene trans-4,5-dihydrodiol Benzo[a]pyrene trans-7,8-dihydrodiol Benzo[a]pyrene trans-9,10-dihydrodiol Benzo[a]pyrene-1,6-quinone Benzo[a]pyrene-3,6-quinone Benzo[a]pyrene-6,12-quinone 3-Hydroxybenzo[a]pyrene 9-Hydroxybenzo[a]pyrene 7b,8a,9a,10b–tetrahydrobenzo[a]pyrene, 7b,8a,9a,10b–tetrahydroxy-7,8,9,10-tetrahydrobenzo[a]pyrene, Benzo[a]pyrene 7,8-dihydrodiol-9,10-epoxide, Glucuronide and Sulfate conjugates of hydroxylated intermediates |
(Cerniglia et al., 1980a, 1980b; Cerniglia and Gibson, 1979, 1980a, 1980b; Haemmerli et al., 1986; Launen et al., 1995) |
| Chrysene | Cunninghamella elegans, Penicillum janthinellum, Syncephalastrum racemosum | (Kiehlmann et al., 1996; Pothuluri et al., 1995) | 2-Chrysenyl sulfate 2-Hydroxy-8-chrysenylsulfate Chrysene trans-1,2-dihydrodiol |
(Kiehlmann et al., 1996; Pothuluri et al., 1995) |
| Benzo[e]pyrene | Cunninghamella elegans | (Pothuluri et al., 1996) | 3-Benzo[e]pyrenyl sulfate 10-Hydroxy-3-benzo[e]pyrenyl sulfate Benzo[e]pyrene-3-0-b-glucopyranoside |
(Pothuluri et al., 1996) |
| Source des données : Kadri et al. (2017) | ||||
| Composé | Formule | Masse molaire (g/mol) | Solubility dans H20 (mg/l) | Potentiel d'ionisation (eV) |
| Naphthalene | C10H8 | 128 | 30 | - |
| Anthracene | C14H10 | 178 | 0,015 | 7.43 |
| Phenanthrene | C14H10 | 178 | 1 - 2 | 8.03 |
| Fluoranthene | C16H10 | 202 | 0,25 | 7.90 |
| Pyrene | C16H10 | 202 | 0,12 - 0,18 | 7.53 |
| Benz[a]anthracene | C18H12 | 228 | 0,0057 | < 7.35 |
| Benz[a]pyrene | - | 252 | 0,0038 | < 7.45 |
| Benzo[b]fluoranthene | C20H12 | 252 | - | 7.70 |
| Benzo[k]fluoranthene | C20H12 | 252 | - | 7.48 |
| Benzo(ghi)perylene | C22H12 | 276 | - | 7.31 |
Figure ci-dessous : aperçu de quelques voies métaboliques de dégradation de composés aromatiques par des bactéries (source : KEGG).
|
| 4. Oxydation des PAH par différentes enzymes de champignons | |||
| Enzymes | Microorganismse | PAH | Produits |
peroxydase de la lignine ou Ligninase H2 |
Phanerochaete chrysosporium P11542 |
B[a]P | B[a]P-1,6-Quinone |
| B[a]P-3,6-Quinone | |||
| B[a]P-6,12-Quinone | |||
| ANT | 9,10-Anthraquinone | ||
| PYR | PYR-1,6-dione; PYR-1,8-dione | ||
| FLA | ----- | ||
| 1-Methylanthracene | 1-Methylanthraquinone | ||
| 2-Methylanthracene | 2-Methylanthraquinone | ||
| 9-Methylanthracene | 9-Anthraquinone; 9-methyleneanthranone; 9-Methanol-9,10-dihydroanthracene |
||
| Acenaphthene | 1-Acenaphthenone; 1-acenaphthenol | ||
| Dibenzothiophene | Dibenzothiophene sulfoxide | ||
| Peroxidase à manganèse (MnP) Basidiomycètes |
Anthracophyllum discolor | PYR; ANT; FLA; PHE | ----- |
| Irpex lacteus P83918 |
PHE; ANT; FLA; PYR | 9,10-Anthraquinone | |
| ANT | Anthrone; 9,10-anthraquinone; 2-(2_-hydroxybenzoyl)-benzoic acid; phthalic acid |
||
| Phanerochaete chrysosporium Q12170 |
FLU | 9-Fluorenone | |
| PHE | PHE-9,10-quinone; 2,2_-diphenic acid | ||
| dibenzothiophene | 4-Methoxybenzoic acid | ||
| Nematoloma frowardii B2BF37_9APHY |
PHE; ANT; PYR; FLA; CHR; B[a]A; B[a]P; benzo[b]fluoranthene |
CO2 from PHE; ANT; PYR; B[a]A; B[a]P | |
| Stropharia coronilla | ANT; B[a]P | 9,10-Anthraquinone; CO2; B[a]P-1,6-quinone | |
| Laccase Ascomycètes et Basidiomycètes |
Trametes hirsuta (Coriolus hirsutus) A0A0A7M685 |
ANT; PHE; PYR; FLA; B[a]P | ----- |
| Coriolopsis gallica C6G7V1 |
B[a]P; ANT; PHE; FLU; 9-Methylanthracene; 2-Methylanthracene; Acenaphthene; carbazole; N-ethylcarbazole; Dibenzothiophene |
9-Fluorenone; dibenzothiophene sulfone | |
| Ganoderma lucidum Q6RYA2 |
ANT; FLU; B[a]A; B[a]P; Acenaphthene; Acenaphthylene |
----- | |
| Pleurotus ostreatus Q6RYA4 |
ANT; PHE; FLU; PYR; FLA; perylene |
9,10-Anthraquinone; 9-fluorenone | |
Pycnoporus cinnabarinus |
B[a]P | B[a]P-1,6-quinone; B[a]P-3,6-quinone; B[a]P-6,12-quinone |
|
| Trametes versicolor D2CSE5 |
Acenaphthene; PHE; ANT; Acenaphthylene, B[a]P; ANT; FLA; PYR; B[a]A; CHR; perylene; benzo[b]fluoranthene; benzo[k]fluoranthene; FLU |
1,2-Acenaphthenedione 1,8-Naphthalic acid anhydride; 9,10-Anthraquinone; PHE-9,10-quinone, 2,2_-Diphenic acid; B[a]P-1,6-quinone; B[a]P-3,6-quinone; B[a]P-6,12-quinone |
|
| ANT : anthracene; B[a]A : benzo[a]anthracene; B[a]P : benzo[a]pyrene; CHR : chrysene; FLA : fluoranthene; FLU : fluorene; PHE : phenanthrene; PYR : pyrene Source des données : Kadri et al. (2017) |
|||
Les tyrosinases -
Ascomycètes et Basidiomycètes Lors de la fixation de l'oxygène, elles catalysent la O-hydroxylation des monophénols (réaction 1 du cycle de la monophénolase) pour générer des intermédiaires O-diphénols oxydés en O-quinones réactives (réaction 2 du cycle de la diphénolase). Les tyrosinases sont des enzymes cytosoliques qui participent à la synthèse des pigments tels que la mélanine. Un exemple célèbre est la tyrosinase de Agaricus bisporus qui induit le brunissement du champignon hôte. |
|||
Autres enzymes - Ascomycètes et Basidiomycètes : nitroréductases, quinone réductases, déhalogénases réductrices ... |
|||
a. Les peroxydases - oxydation extracellulaire Les principales peroxydases à haut potentiel rédox de champignons dites de classe II, sont impliquées dans la biodégradation de la ligno-cellulose avec une gamme exceptionnelle de substrats organiques et inorganiques. Les peroxydases sont des enzymes contenant un seul hème (protoporphyrine IX), de sorte que le spectre d'absorption de ces enzymes a un maximum d'absorbance particulier à 406-409 nm. Les peroxydases sont divisées en plusieurs types. Les peroxydases des lignines (ligninase, LiP - E.C. 1.11.1.14) La valeur du potentiel rédox du groupement hème (atome de fer - E0' = +1,2 V à +1,5 V) permet que le site catalytique de ces enzymes oxyde une grande variété de substrats phénoliques et non phénoliques en présence de H2O2.
Il existe une très grande diversité / hétérogénéïté de lignines. Elles constituent la source de carbone organique la plus importante sur terre et représentent près de 30% du carbone séquestré chaque année dans les matières végétales. Des fragments de type lignine étaient présents il y a environ 430 millions d'années. Ce sont des polymères non linéaires complexes, dont le précurseur est la phénylalanine.
La proportion de chacun des 3 monomères constitutifs des lignines permet de les classer : lignines d'herbacées, de résineux et de feuillus. Les peroxidases à manganèse (MnP - E.C .1.11.1.13)
Autres types de peroxydases Les peroxydases décolorantes de pigments ("dye-decolorizing peroxidases" - DyP - E.C. 1.11.1.19 - Basidiomycètes) :
Les chloroperoxydases halogénantes (E.C. 1.11.1.10 - Ascomycètes) et les peroxygénases non spécifiques ou aromatiques (E.C. 1.11.2.1) :
|
b. Les laccases - oxydation extracellulaire Les laccases (E.C. 1.10.3.2) sont des oxydoréductases à cuivre (4 atomes de cuivre par enzyme) trouvées dans de nombreuses plantes, champignons et micro-organismes. Ces enzymes ont une masse molaire ≥ 60 kDa (supérieures à celles des peroxydases) et un point isoélectrique acide. Les laccases sont glycosylées. Les laccases catalysent l'oxydation directe de divers phénols, des polyphénols et des anilines, très présents chez les végétaux supérieurs, les champignons et les bactéries. |
Exemple de réaction d'oxydation avec échange d'électrons (réduction de O2 en H2O avec 4 électrons) : 4 benzène-diol + O2 <=> 4 benzo-semiquinone + 2 H2O Valeur du potentiel rédox : E0' = +0,4 V à +0,8 V. |
 |
Visualisation de la laccase de Coriolopsis trogii à une résolution de 1,58 Å Code PDB : 2HRG - Matera et al. (2007) Voir le champignon Coriolopsis trogii.
|
Activité des laccases et médiateurs Certaines laccases participent à la formation des lignines en favorisant le couplage oxydatif des monolignols (famille de phénols naturels). D'autres laccases (par exemple, celle du champignon Pleurotus ostreatus) participent à la dégradation des lignines.
La valeur du potentiel rédox du systéme des atomes de cuivre (E0' = +0,4 V à +0,8 V) est trop faible pour que le site catalytique de cette famille d'enzymes oxyde des dérivés non phénoliques. Des molécules, appelées médiateurs, participent à la catalyse. Les médiateurs possèdent un potentiel redox plus élevé que celui des laccases : ce sont des molécules oxydables par les laccases et qui, une fois oxydées, transfèrent les électrons qui, à leur tour, oxydent un grand nombre de substrats En présence de médiateurs appropriés, les laccases ont donc une une capacité d'oxydation plus grande : elles peuvent alors oxyder une gamme plus diversifiée de composés, tels que les PAH. Cette particularité a de nombreuses applications biotechnologiques (oxydation des lignines non phénoliques, détoxification de divers polluants environnementaux, traitement des eaux usées).
Il existe 3 types de mécanisme d'action des médiateurs
Motifs consensus (exemple : Laccase de Scedosporium apiospermum => XP_016638801) :
|
|
c. Les cytochromes P450 - oxydation intracellulaire initiale puis excrétion des métabolites Les enzymes cytochromes P450 (CYP) sont des oxydoréductases qui appartiennent à la superfamille des mono-oxygénases (E.C. 1.14.14.-).
Un très grand nombre de cytochromes P450
Exemple de nomenclature des sous-familles de CYP : CYP27A1 indique le gène 1 codant le cytochrome P450 du groupe 27, de la sous-famille A. Malgré ce nombre très important, des motifs consensus sont retrouvés dans les séquences d'acides aminés des CYP :
Classification des CYP des champignons CYP de la classe II :
Exemples :
CYP de la classe VIII :
Exemples :
CYP de la classe IX :
Exemple : CYP55A1 (appelé aussi P450nor) de Fusarium oxysporum (P23295) |
| Famille P450 | Fonction | Espèces |
| CYP51 | biosynthèse ergosterol membrane | S. cerevisiae, C. albicans |
| CYP61 | biosynthèse ergosterol membrane | S. cerevisiae, C. glabrata |
| CYP56 | N,N'-production bisformyl dityrosine de la paroi externe des spores | S. cerevisiae, C. albicans |
| CYP52 | ndégradation alcanes et acides gras | Candida spp. |
| CYP58 | biosynthèse aflatoxin | A. flavus, A. parasiticus |
| CYP59 | ||
| CYP60 | ||
| CYP64 | ||
| CYP62 | ||
| CYP65 | biosynthèse trichothecene | F. graminearum, F. sporotrichoides |
| CYP526 | ||
| CYP68 | ||
| CYP58 | ||
| CYP505 | biosynthèse fumonisine | F. verticilliodes |
| CYP65 | ||
| CYP68 | biosynthèse gibberelline | F. fujikori |
| CYP69 | ||
| CYP503 | ||
| CYP57 | détoxification pisatine (pterocarpane isoflavonoide) | N. haematococca |
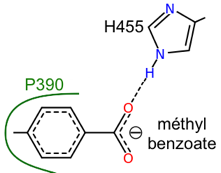
| CYP53 | dégradation benzoate et dérivés | A. niger, A. nidulans, C. lunatus, P. chrysosporium |
| CYP504 | dégradation phenylacétate et dérivés | A. nidulans |
| CYP505 | hydroxylation (carbones ω1 à ω3) des acides gras | F. oxysporum |
| CYP55 | Dénitrification | F. oxysporum, C. tokinese, A. oryzae, T. cutaneum |
| Source : Cresnar & Petric (2011) | ||
|
CYP53A (champignons ascomycètes Aspergillus niger, Aspergillus nidulans et Cochliobolus lunatus / champignon basidiomycète Phanerochaete chrysosporium) : hydroxylation de l'acide benzoïque et d'autres dérivés mono-substitués du benzoate formant des produits p-hydroxylés dégradé par la voie du β-cétoadipate. Voir la voie de dégradation du benzoate. CYP57A1 (PDA) : pisatine déméthylase de Necria haematococca (anamorphe de Fusarium solani) - souches pathogènes pour le pois (Pisum sativum). CYP504A1 et CYP504B1 : dégradation de composés aromatiques exogènes chez Aspergillus nidulans poussant sur le phénylacétate et ses dérivés hydroxyles comme seules sources de carbone.
|
d. Parois cellulaires des plantes et autres enzymes Les parois cellulaires des plantes sont uniques tant du point de vue structural que fonctionnel. Elles peuvent être divisées en lamelles moyennes, parois cellulaires primaires et parois cellulaires secondaires. La composition chimique des parois des cellules végétales varie considérablement entre les monocotylédones, les dicotylédones, les résineux et les feuillus. La cellulose, l'hémicellulose et la pectine (polysaccharide non cellulosique) sont les polysaccharides les plus importants des parois cellulaires des plantes. La cellulose est un polymère de glucose, l'hémicellulose est composée d'oses en C6 (glucose, mannose, galactose) et en C5 (xylose, arabinose). Les enzymes qui décomposent la cellulose, l'hémicellulose et la lignine sont généralement appelées cellulases, hémicellulases et enzymes de modification de la lignine ("lignin-modifying enzymes"). La base de données CAZy ("Carbohydrate-Active enZYmes Database") décrit les familles de domaines fonctionnels (domaines catalytiques et de fixation aux glucides) des enzymes qui dégradent, modifient ou créent des liaisons glycosidiques. Les enzymes de modification et de dégradation de la paroi des cellules végétales sécrétées par des microorganismes ont été classées en 6 classes dans CAZy : glycoside hydrolases (GH), glycosyl transferases (GT), activité auxiliaire ("Auxiliary Activity", AA), carbohydrate esterase (CE), les polysaccharides lyases (PL) et les domaines de liaison aux glucides ("carbohydrate-binding domains"). |
5. Les fungi a. Le règne des champignons (eumycota, fungus, fungi) On dénombre environ 100.000 organismes du règne des champignons qui comprend les levures, les rouilles, les charbons, les moisissures et les champignons. On suppose qu'il puisse en exister plusieurs millions. Principaux groupes : Chytridiomycota, Zygomycota, Glomeromycota, Ascomycota et Basidiomycota.
Source : Introductory Mycology BOT 461/561 La majorité (~ 98%) des espèces fongiques décrites sont des membres du clade dikarya, qui comprend les phyla Ascomycota et Basidiomycota :
Source : MycoCosm ("The fungal genomics resource") |
|
b. Exemples d'enzymes de champignon impliquées dans les voies de dégradation d'hydrocarbures et de PAH
Source : Morales et al. (2017) |
| Enzyme | Voie métabolique | Gènes |
| Cytochrome P450 monooxygénase (EC:1.14.13.12) | dégradation des PAH, biodégradation d'alcanes | 79 |
| phénol hydroxylase | dégradation du phénol | 4 |
| Epoxide hydrolase (EC:3.3.2.9) | dégradation des PAH | 3 |
| Oxydoréductase | métabolisme de composés organiques | 13 |
| Salicylate hydroxylase (EC:1.14.13.24) | dégradation du naphthalène | 13 |
| Laccase (EC:1.10.3.2) | dégradation des PAH | 2 |
| Catéchol 1,2-dioxygénase (EC:1.13.11.1) | dégradation du phénol | --- |
| 2,4-dichlorophénol 6-monooxygénase (EC:1.14.13.7; EC:1.14.13.20) | dégradation de dérivés chlorés du phénol | 5 |
| 2,3-dihydroxybenzoate decarboxylase (EC:4.1.1.46) | dégradation du 2,3-dihydroxybenzoate | 1 |
| Carboxy-cis,cis-muconate cyclase | dégradation du phénol | 4 |
| Phenylacetate 2-hydroxylase | dégradation de l'homogentisate | 1 |
| 2-nitropropane dioxygénase (EC:1.13.12.16) | oxydation du nitroalquène | 4 |
| Biphenyl-2,3-diol 1,2-dioxygénase | dégradation du biphenyl | 1 |
| Dienelactone hydrolase | dégradation de dérivés aromatiques chlorés | 2 |
| Vanillyl-alcohol oxidase (EC:1.1.3.38) | dégradation de dérivés aromatiques | 4 |
| Cyclopentanone 1,2-monooxygénase (EC:1.14.13.8; EC:1.14.13.16) | dégradation du cyclopentanol | 2 |
| Tyrosinase | dégradation de composés phénoliques | 1 |
| Lignostilbene dioxygénase (EC:1.13.11.43) | dégradation de la lignine | 2 |
| nombre total de gènes | ----- | 145 |
| Source : Morales et al. (2017) | ||
|
6. Dégradation des dérivés du benzène et du phénol
a. Dégradation de l'acide 4-hydroxybenzoïque La 4-hydroxybenzoate 3-monooxygénase (E.C. 1.14.13.2) dégrade l'acide 4-hydroxybenzoïque :
|
b. Autres voies de dégradation connues La levure pathogène Candida parapsilosis ne dégrade pas le phénol, le catéchol (1,2-dihydroxybenzène), le salicylate (2-hydroxybenzoate) ni le 2,3-dihydroxybenzoate. Cependant, elle se développe sur plusieurs dérivés hydroxy du benzène et de l'acide benzoïque (exemples : 3-hydroxybenzoate, 4-hydroxybenzoate, gentisate, hydroquinone, protocatéchuate, résorcinate, résorcinol). Le catabolisme de ces composés se fait par l'intermédiaire :
Source : Holesova et al. (2011) Les transporteurs mitochondriaux relient le catabolisme de ces composés au métabolisme central de Candida parapsilosis. Ces transporteurs appartiennent à la famille des transporteurs MFS ("Major Facilitator Superfamily") et sont les équivalents des symports [acide aromatique:H+] des bactéries. Voir un cours sur les transports biologiques et les transporteurs. Comparaison des voies de dégradation des hydroxybenzènes et des hydroxybenzoates chez les levures Candida parapsilosis et Candida albicans
Source : Cillingova et al. (2017) Les deux espèces de Candida diffèrent par les voies biochimiques impliquées dans la dégradation des substrats hydroxy-aromatiques et par les systèmes de transport de ces composés :
Bien que le variant HHQ de la voie 3-oxoadipate opère dans les deux espèces, Candida albicans ne possède pas la monooxygénase décarboxylante Mnx1 ni le transporteur d'hydroxybenzoate Hbt2 (présents chez Candida parapsilosis).
Enzymes : 3-hydroxybenzoate 6-hydroxylase and 4-hydroxybenzoate 1-hydroxylase |
7. Quelques molécules thérapeutiques polluantes Un xénobiotique ("xenos" : étranger & "bios" : vie) est une molécule polluante et parfois toxique que l'on trouve dans un organisme bien qu'elle lui soit étrangère. Exemples : les pesticides, les médicaments, les antibiotiques. Certains médicaments largement utilisés comme l'ibuprofène, le diclofénac, les hormones synthétiques sont présents à des concentrations élevées dans l'environnement. La présence de ces micropolluants mobilise de plus en plus les compagnies d'eau potable et les institutions en charge de la pureté des ressources en eau. L'ibuprofène (C13H18O2) appartient à la classe des composés acides phenylpropanoiques.
Rôles biologiques :
L'ibuprofène est presque complètement métabolisé. La principale voie d'élimination est le métabolisme oxydatif par les enzymes cytochrome P450. L'oxydation de la chaîne isopropyle de l'ibuprophène par Trametes versicolor forme le 1-hydroxy ibuprophène et le 2-hydroxy ibuprophène, eux-mêmes transformés en 1,2-dihydroxy ibuprofène (Marco-Urrea et al., 2009) qui n'est pas dégradé : l'écotoxicité des effluents traités est donc supérieure à celle de la solution initiale.
|
b. L'acétaminophène ou paracétamol L'acétaminophène ou paracétamol (N-acétyl-p-aminophénol ou 4'-hydroxyacétanilide) est un antalgique. Il est vendu à des milliards de doses dans le monde depuis des années. L'acétaminophène (C8H9NO2) appartient à la classe des composés phénoliques (acétamide).
Effets biologiques : ce n'est pas un anti-inflammatoire. On suspecte que l'hépatotoxicité induite par l'acétaminophène soit une cause majeure d'insuffisance hépatique.
Voir les informations PUBCHEM pour l'acide acétylsalicylique. Quelques métabolites issus de la dégradation de l'acétaminophène par les bactéries dans le sol : 3-hydroxyacétaminophène, hydroquinone, 1,4-benzoquinone, N-acétyl-p-benzoquinone imine, p-acétanisidide, 4-méthoxyphénol, acide 2-hexénoïque et 1,4-diméthoxybenzène.
Voir Pontié et al. (2019) : article sur la biodégradation de l'acétaminophène par Scedosporium dehoogii dans une biopile. |
|
La carbamazépine (C15H12N20) appartient à la classe des dibenzazepines (2 noyau benzène reliés par un noyau azepine).
Effets biologiques : la carbamazépine (vendue sour le nom Tegretol) est prescrite conte l'épilepsie. C'est un anti-convulsif. Elle est biodégradée à 100 % par Pleurotus ostreatus et à 76% parTrametes versicolor ATCC 42530. L'action de la laccase de Trametes versicolor en présence du médiateur rédox 1-hydroxybenzotriazole (HBT) aboutit à la synthèse de la 10,11-dihydro-10,11-époxycarbamazepine (CBZP-époxide) et de la 9(10H)-acridinone (Toran M. J., 2018). L'écotoxicité des effluents traités est inférieure à celle de la solution initiale.
|
|
La danofloxacine (C19H20FN303) appartient à la classe des fluoroquinolones. C'est un antibiotique à usage vétérinaire.
|
e. Le diclofénac Cette molécule (C14H11Cl2NO2, appelée aussi Voltaren) appartient à la classe des anti-inflammatoires non stéroïdiens.
La bioremédiation par le champignon de la pourriture blanche Trametes versicolor forme divers intermédiaires plus ou moins toxiques (Marco-Urrea et al., 2010). Le 4-(2,6 dichlorophénylamino)-1,3-benzènediméthanol est un composé biodégradable.
Voir Pontié et al. (2018) : article sur la biodégradation du diclofénac par Scedosporium dehoogii dans une biopile. |
9. Etude de composés phénoliques comme source de carbone : exemple du toluène Courbes de croissance de Cladophialophora immunda (souche 17, CBS 110551). La densité optique à 700 nm a été enregistrée en fonction des jours de culture dans des plaques de microtitrage.
Source : Blasi et al. (2016) (H) : milieu complémenté en toluène; (G) : milieu complémenté en glucose; (GVT) : milieu complémenté en glucose, vitamines et oligo-éléments. Le champignon Cladophialophora immunda a été cultivé en présence de toluène comme unique source de carbone et d'énergie.
De telles études apportent des information en ce qui concerne l'écologie de certaines espèces de champignons et leurs stratégies d'adaptation aux environnements pollués par les hydrocarbures. |
| 10. Liens Internet et références bibliographiques | |
|
"Introduction à la science du sol" (7è Ed). (2018) P. Duchaufour et coll. - Editions DUNOD - ISBN : 978-2-10-077656-6 MycoBank MycoCosm "FungiDB: The Fungal and Oomycete Genomics Resource" "The Human Metabolome Database" Base de données CAZy ("Carbohydrate-Active enZYmes Database") "Polycyclic Aromatic Hydrocarbon database" |
|
Bezalel et al. (1996) "Mineralization of polycyclic aromatic hydrocarbons by the white rot fungus Pleurotus ostreatus" Appl. Environ. Microbiol. 62, 292 - 295 Rowlinson et al. (2003) "A novel mechanism of cyclooxygenase-2 inhibition involving interactions with Ser-530 and Tyr-385" J. Biol. Chem. 278 45763 - 45769 Gerini et al. (2003) "Molecular dynamics simulations of lignin peroxidase in solution" Biophys. J. 84, 3883 - 3893 |
|
|
Hannemann et al. (2007) "Cytochrome P450 systems--biological variations of electron transport chains" Biochim. Biophys. Acta. 1770, 330 - 344 Gilgado et al. (2008) "Molecular and phenotypic data supporting distinct species statuses for Scedosporium apiospermum and Pseudallescheria boydii and the proposed new species Scedosporium dehoogii" J. Clin. Microbiol. 46, 766 - 771 Marco-Urrea et al. (2009) "Ability of white-rot fungi to remove selected pharmaceuticals and identification of degradation products of ibuprofen by Trametes versicolor" Chemosphere 74, 765 - 772 Hata et al. (2010) "Elimination of carbamazepine by repeated treatment with laccase in the presence of 1-hydroxybenzotriazole" J. Hazard. Mater. 181, 1175 - 1178 |
|
|
Harms et al. (2011) "Untapped potential: exploiting fungi in bioremediation of hazardous chemicals" Nat. Rev. Microbiol. 9, 177 - 192 Cresnar & Petric (2011) "Cytochrome P450 enzymes in the fungal kingdom" Biochim. Biophys. Acta (BBA) - Proteins and Proteomics 1814, 29-35 Holesova et al. (2011) "Gentisate and 3-oxoadipate pathways in the yeast Candida parapsilosis: identification and functional analysis of the genes coding for 3-hydroxybenzoate 6-hydroxylase and 4-hydroxybenzoate 1-hydroxylase" Microbiology 157, 2152 - 2163 Rodarte-Morales et al. (2012) "Biotransformation of three pharmaceutical active compounds by the fungus Phanerochaete chrysosporium in a fed batch stirred reactor under air and oxygen supply" Biodegradation 23, 145 - 156 |
|
|
Langenhoff et al. (2013) "Microbial removal of the pharmaceutical compounds ibuprofen and diclofenac from wastewater" Biomed. Res. Int. 2013, 325806 Li et al. (2014) "Degradation and transformation products of acetaminophen in soil" Water Res. 49, 44 - 52 Ortiz de Garcia et al. (2014) "Ecotoxicity and environmental risk assessment of pharmaceuticals and personal care products in aquatic environments and wastewater treatment plants" Ecotoxicol. 23, 1517 – 1533 |
|
|
Mazaleuskaya et al. (2015) "PharmGKB summary: ibuprofen pathways" Pharmacogenet. Genomics 25, 96 - 106 Xu et al. (2015) "Structural basis for the 4'-hydroxylation of diclofenac by a microbial cytochrome P450 monooxygenase" Appl. Microbiol. Biotechnol. 99, 3081 - 3091 Biswas et al. (2015) "Bioremediation of PAHs and VOCs: advances in clay mineral-microbial interaction" Environ. Int. 85, 168 - 181 Wang et al. (2015) "A functional 4-hydroxybenzoate degradation pathway in the phytopathogen Xanthomonas campestris is required for full pathogenicity" Sci. Rep. 5, 18456 Pollegioni et al. (2015) "Lignin-degrading enzymes" FEBS J. 282, 1190 - 1213 |
|
|
Blasi et al. (2016) "Pathogenic yet environmentally friendly ? Black fungal candidates for bioremediation of pollutants" Geomicrobiol. J. 33, 308 - 317 Mbokou et al. (2016a) "Electroanalytical performance of a carbon paste electrode modified by coffee Husks for the quantification of acetaminophen in quality control of commercialized pharmaceutical tablets" Int. J. Electrochem. 2016, Art. ID 1953278 Mbokou et al. (2016b) "Evaluation of the degradation of acetaminophen by the filamentous fungus Scedosporium dehoogii using carbon-based modified electrodes" Anal. Bioanal. Chem. 408, 5895 - 5903 |
|
Alvarez & Sanhueza (2016) "New record of Scedosporium dehoogii from Chile: Phylogeny and susceptibility profiles to classic and novel putative antifungal agents" Rev. Iberoam. Micol. 33, 224 - 229 Yang et al. (2016) "A monooxygenase from Boreostereum vibrans catalyzes oxidative decarboxylation in a divergent vibralactone biosynthesis pathway" Angew. Chem. Int. Ed. Engl. 55, 5463 - 5466 A. Rakotovelo (2016) "Fragmentation enzymatique de la lignine pour l'obtention de synthons phénoliques" Polymères. Université de Bordeaux - NNT : 2016BORD0247 aus der Beek et al. (2016) "Pharmaceuticals in the environment - Global occurrences and perspectives" Environ. Toxicol. Chem. 35, 823 - 835 |
|
Morales et al. (2017) "The genomic study of an environmental isolate of Scedosporium apiospermum shows its metabolic potential to degrade hydrocarbons" Stand. Genomic. Sci. 12, 71 Kadri et al. (2017) "Biodegradation of polycyclic aromatic hydrocarbons (PAHs) by fungal enzymes: A review" J. Environ. Sci. (China) 51, 52 - 74 Blasi et al. (2017) "Genomic and transcriptomic analysis of the toluene degrading black yeast Cladophialophora immunda" Sci. Rep. 7, 11436 Mbokou et al. (2017) "Development of a novel hybrid biofuel cell type APAP/O2 based on a fungal bioanode with a Scedosporium dehoogii biofilm" J. Applied Electrochem. 47, 273 - 280 |
----- |
Mazlan et al. (2017) "A New Laccase Based Biosensor for Tartrazine" Sensors (Basel) 17, 2859 Sys et al. (2017) "Electrochemical study of trametes versicolor laccase compatibility to different polyphenolic substrates" Chemosensors 5, 9 Cillingova et al. (2017) "Eukaryotic transporters for hydroxyderivatives of benzoic acid" Sci. Rep. 7, 8998 Nelson D.R. (2018) "Cytochrome P450 diversity in the tree of life" Biochim. Biophys. Acta. 1866, 141 - 154 Pontié et al. (2018) "Enhanced direct oxidation of diclofenac (DCF) at a carbon paste electrode (CPE) modified with cellulose and its biodegradability by Scedosporium dehoogii" Res. Rev. Electrochem. 9, 114 - 128 |
|
Ecker & Fulop (2018) "Lignin peroxidase ligand access channel dysfunction in the presence of atrazine" Sci. Rep. 8, 5989 Toran M. J. (2018) "Continuous wastewater treatment by Trametes versicolor immobilized on lignocellulosic support" PhD Thesis, Universitat Autonoma de Barcelona, Bellaterra Vermaas et al. (2019) "Systematic parameterization of lignin for the CHARMM force field" Green Chem. DOI: 10.1039/C8GC03209B Pontié et al. (2019) "A sustainable fungal microbial fuel cell (FMFC) for the bioremediation of acetaminophen (APAP) and its main by-product (PAP) and energy production from biomass" Biocatal. Agric. Biotechnol. 22, 101376 |
|
Larsen & Wigginton (2020) "Tracking COVID-19 with wastewater" Nature Biotechnol. 38, 1151 - 1153 |
|