Exercice n°1 (3 points)
| A1. ΔG°’réaction sens A -> B = -3,27 kJ.mol-1, alors ΔG°’réaction sens B -> A = 3,27 kJ.mol-1. | VRAI |
| A2. ΔG’réaction sens A -> B = -3,27 kJ.mol-1, alors ΔG’réaction sens B -> A = 3,27 kJ.mol-1. | VRAI |
| A3. KM est une concentration. | VRAI |
| A4. L'hypothèse du quasi-équilibre stipule que k-1 >> kcat. | VRAI |
| A5. Le transport actif primaire utilise de l'énergie pour transporter un soluté dans le sens de son gradient de concentration. | FAUX |
| A6. Un transporteur qui assure la diffusion facilitée est saturable. | VRAI |
Exercice n°2 (1 point)
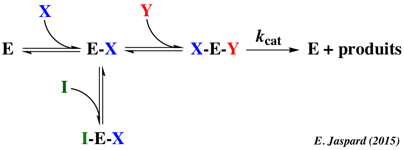
Ecrire le schéma réactionnel du système suivant :
- mécanisme ordonné à 2 substrats (X et Y) et X est le 1er substrat
- I est un inhibiteur incompétitif de X
Exercice n°3 (8 points). Répondre de manière claire et simple par quelques mots-clés.
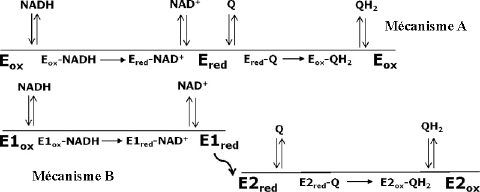
Considérons la figure ci-contre. Source : Yano et al. (2014) Biochemistry 53, 1179 - 1190 |
|
|
Q1. A quel(s) type(s) de mécanisme(s) à 2 substrats correspondent respectivement les mécanismes A et B ? |
mécanisme A : ping-pong un site mécanisme B : ping-pong deux sites |
|
Q2. Dans quel grand processus biologique cette enzyme intervient-elle ? |
Transfert des électrons - phosphorylation oxydative |
|
Q3. Que signifie « Q » dans ces schémas ? |
Quinone (coenzyme Q) |
|
Q4. Mécanisme A : « both NADH oxidation and quinone reduction occur on the same face of the isoalloxazine ring. Consequently, the binding of each substrate is mutually exclusive because of the overlap between binding sites ». Quel type d’inhibition les substrats exercent-ils les uns sur les autres ? |
Ce chevauchement permet une inhibition compétitive :
|
|
Q5. Soit la réaction : A + 2 B <=> 3 C. Ecrire l’expression de la constante d’équilibre. |
Keq = [C]3 / [A] x [B]2 |
|
Q6. Calculer la valeur de cette constante d’équilibre (question Q5) sachant que ΔG°’ = -5 kJ.mol-1. |
Keq = 6,97 |
|
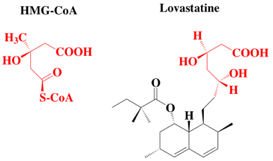
Q7. Sachant que le substrat d’une enzyme est HMG-CoA, quel type d’inhibiteur est la lovastatine ?
|
Compétitif |
|
Q8. Pourquoi ? |
Analogue structural |
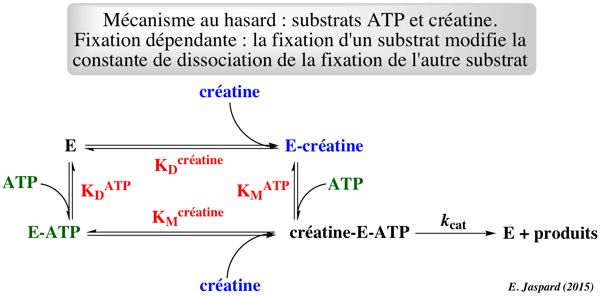
Exercice n°4 (8 points)
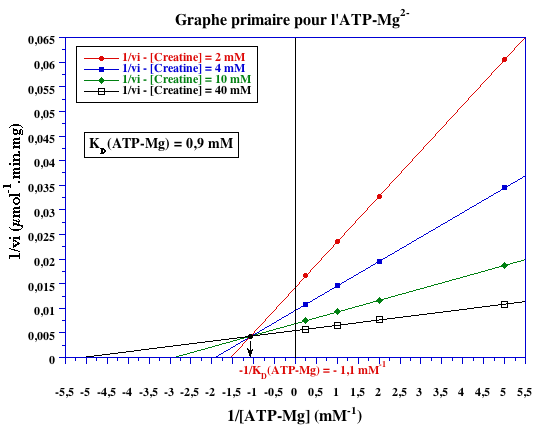
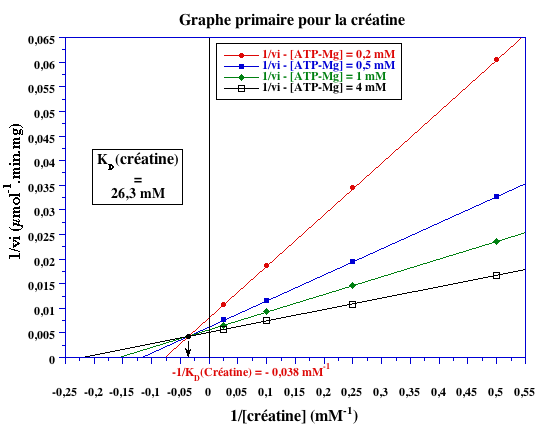
Graphes primaires
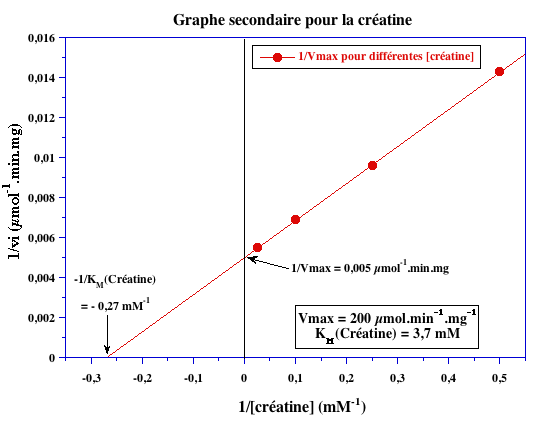
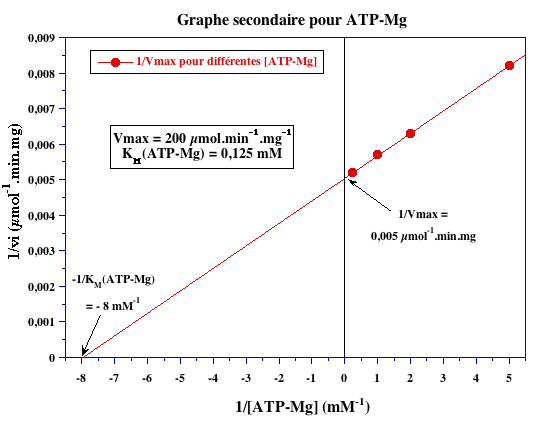
Graphes secondaires
| Paramètres | ATP-Mg2- | Créatine |
1/VM (µmoles-1.min.mg) |
0,005 | 0,005 |
VM (µmoles.min-1.mg-1) |
200 |
200 |
-1/KD (mM-1) |
- 1,1 | - 0,038 |
KD (mM) |
0,9 | 26,3 |
| -1/KM (mM-1) | - 8 | - 0,27 |
| KM (mM) | 0,125 | 3,7 |
Schéma catalytique complet Le point de concourance des droites des graphes primaires se situe au dessus de l'axe des abcisses. Celà indique une fixation dépendante des substrats.
|