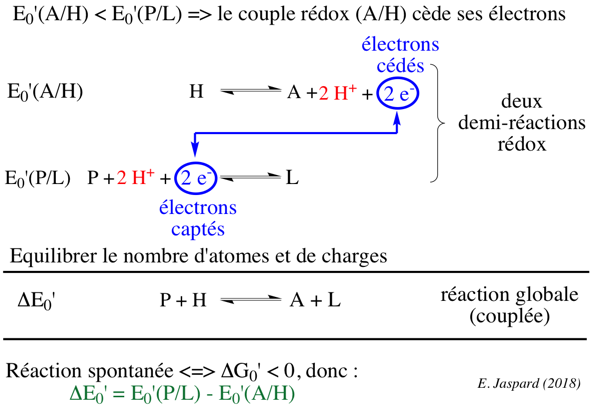
Règle pour orienter 2 demi-réactions rédox impliquant 2 couples rédox : le couple rédox qui a le potentiel de réduction standard E°' le plus faible cède ses électrons à l'autre couple rédox.
| Correction Exercice 1 - Bioénergétique - Oxydo-réduction |
|
Règle pour orienter 2 demi-réactions rédox impliquant 2 couples rédox : le couple rédox qui a le potentiel de réduction standard E°' le plus faible cède ses électrons à l'autre couple rédox.
|
Réaction 1 1ère réaction rédox : β-hydroxybutyrate <=> acétoacétate + 2 H+ + 2 e- E°'(acétoacétate / β-hydroxybutyrate) = - 0,35 V Couplage dans le sens thermodynamiquement spontané : β-hydroxybutyrate + pyruvate <=> acétoacétate + lactate Réaction 2 1ère réaction rédox : β-hydroxybutyrate <=> acétoacétate + 2 H+ + 2 e- E°'(acétoacétate / β-hydroxybutyrate) = - 0,35 V
Réaction 3 1ère réaction rédox : FADH2 <=> FAD + 2 H+ + 2 e- E°'(FAD / FADH2) = - 0,06 V
|
Réaction 4 1ère réaction rédox : NADPH + H+ <=> NADP+ + 2 H+ + 2 e- E°'(NADP+ / NADPH) = - 0,32 V
Calcul de ΔG°'réaction Relation entre la variation d'énergie libre de Gibbs dans les conditions standard et la différence de potentiel de réduction standard : ΔG°'réaction = - n . F . ΔE°'réaction Si une réaction se déroule dans le sens spontané alors ΔG°' < 0 : la différence ΔE°'réaction doit donc être positive du fait du signe "-" dans cette relation. => ΔG°'réaction = - 2 . 23060 . [- 0,14 - (- 0,32)] = - 8,3 kcal.mol-1 Avec : F = 23060 cal.V-1 Voir un cours sur la variation d'énergie libre de Gibbs dans les conditions standard. |