
| La β-oxydation des acides gras et la cétogénèse |
| Tweet |
 |
|
1. Présentation générale 2. Activation des acides gras 3. Entrée dans la mitochondrie : rôle de la carnitine 4. La β-oxydation
|
5. La cétogénèse 6. Liens Internet et références bibliographiques |
1. Présentation générale L'oxydation des acides gras est la source majeure d'ATP. Certains oiseaux migrateurs parcourent 1500 km en une fois à la vitesse de 35km/h : seuls les "combustibles" lipidiques apportent une telle énergie. En comparaison, le glycogène fournit aux muscles une quantité d'ATP qu'ils consomment en 1 heure. L'oxydation des acides gras est donc une voie métabolique capitale pour l'homéostasie énergétique de la cellule (foie, coeur, muscle squelettique), notamment en période de jeûne (le cerveau ne catabolise pas les acides gras en période de jeûne). De plus, le foie transforme, dans certaines conditions, les acides gras en corps cétoniques qui sont une source additionnelle d'énergie pour tous les tissus, y compris le cerveau. Les acides gras sont principalement synthétisés dans le foie. Ils dérivent des triglycérides des lipoprotéines du sang ou des adipocytes (tissus adipeux). Ils sont stockées sous forme d'esters d'acides gras dans les adipocytes. Chez les mammifères, les lipides alimentaires sont essentiellement des triacylglycérols. La digestion des lipides alimentaires commence quand ils se mélangent, dans l'intestin, aux sels biliaires (principaux sels biliaires chez l'homme : acide taurocholique, acide glycocholique - dérivés du cholestérol). Quand le taux d'adrénaline augmente dans le sang (jeûne ou exercice), la stimulation de récepteurs β-adrénergiques à la surface des adipocytes active l'adénylate cyclase qui catalyse la formation d'AMP cyclique (AMPc). La protéine kinase dépendante de l'AMPc active une lipase par phosphorylation. Les acides gras et le glycérol sont libérés des triacylglycérols et ils traversent la membrane plasmique. |
|
Les triacylglycérols sont hydrolysés sur le C1 et le C3 par la lipase pancréatique, ce qui libère des acides gras, des intermédiaires (1,2-diacylglycérol et 2,3-diacylglycérol) et enfin le 2-monoacylglycérol.
Les phospholipases A2 (EC 3.1.1.4) hydrolysent spécifiquement la liaison acyle sn-2 du carbone 2 du glycérol des glycérophospholipides :
Cette hydrolyse relargue l'acide arachidonique et des lysophospholipides. |
| Exemples d'acides gras | |||||
| Carbone | Doubles liaisons | Position des doubles liaisons | Nom commun | Nom IUPAC | Point de fusion |
| 12 | 0 | C12:0 | laurate (acide laurique) |
dodécanoate (acide dodécanoique) |
43°C |
| 14 | 0 | C14:0 | myristate | tétradécanoate | 52°C |
| 16 | 0 | C16:0 | palmitate | hexadécanoate | 63°C |
| 18 | 0 | C18:0 | stéarate | octadécanoate | 70°C |
| 20 | 0 | C20:0 | arachidate | icosanoate | 75°C |
| 22 | 0 | C22:0 | béhénate | docosanoate | 81°C |
| 24 | 0 | C24:0 | lignocérate | tétracosanoate | 84°C |
| 16 | 1 | C16:1 Δ9 | palmitoléate | cis-Δ9-hexadécénoate | - 0,5°C |
| 18 | 1 (végétaux) | C18:1 Δ9 (acide gras ω-9) | oléate | cis-Δ9-octadécénoate | 13°C |
| 18 | 2 (végétaux) | C18:2 Δ9,12 (acide gras ω-6) | linoléate | cis,cis-Δ9,12-octadécadiénoate | - 9°C |
| 18 | 3 (végétaux) | C18:3 Δ9,12,15 (acide gras ω-3) | linolénate | all-cis-Δ9,12,15-octadécatriénoate | - 17°C |
| 18 | 4 (végétaux) | C18:4 Δ6,9,12,15 (acide gras ω-3) | stéaridonate | all-cis-Δ6,9,12,15-octadécatétraénoate | ------ |
| 20 | 4 (animaux) | C20:4 Δ5,8,11,14 (acide gras ω-6) | arachidonate | all-cis-Δ5,8,11,14-icosatétraénoate | - 49°C |
| 20 | 5 (poisson) | C20:5 Δ5,8,11,14,17(acide gras ω-3) | eicosapentaénoate | all-cis-Δ5,8,11,14,17-eicosapentaénoate | ------ |
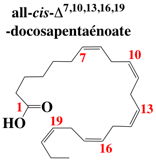
| 22 | 5 (animaux) |
C22:5 Δ4,7,10,13,16 (acide gras ω-6) C22:5 Δ7,10,13,16,19 (acide gras ω-3) |
clupanodonate |
all-cis-Δ4,7,10,13,16-docosapentaénoate all-cis-Δ7,10,13,16,19-docosapentaénoate |
 |
| 22 | 6 (animaux) | C22:6 Δ4,7,10,13,16,19 (acide gras ω-3) | cervonate | all-cis-Δ4,7,10,13,16,19-docosahexaenoate | - 44°C |
| 24 | 6 | C24:6 Δ6,9,12,15,18,21 (acide gras ω-3) | nisinate | all-cis-Δ6,9,12,15,18,21-tétracosahexaénoate | ------ |
Le glycérol est métabolisé dans le foie : il y est essentiellement utilisé pour former du glucose via la néoglucogénèse. Les acides gras sont transportés via la circulation sanguine par un sytème complexe avec l'albumine. Ils sont alors distribués dans le coeur, le muscle squelettique et le foie, où ils sont oxydés. La β-oxydation des acides gras a lieu dans la matrice de la mitochondrie où les enzymes de la β-oxydation sont à proximité des complexes de la chaîne respiratoire. La β-oxydation a lieu sur le carbone en position β et correspond à l'hydrolyse successive des 2 carbones (expérience de Knoop) en position C-terminale de l'acide gras : acide gras à n carbones => acide gras à n-2 carbones => acide gras à n-4 carbones ...
Il existe une α-oxydation (acides gras à chaîne branchée comme l'acide phytanique) et une ω-oxydation (exemples : acide ω-phenylvalérique et acide ω-phenylbutyrique). Les peroxysomes sont capables d'oxyder de nombreux substrats y compris les esters d'énoyl-CoA poly-insaturés. La β-oxydation dans les peroxysomes (mais aussi dans les mitochondries) implique le métabolisme de doubles liaisons carbone-carbone pré-existantes. En plus des enzymes de l'hélice de Lynen, ce métabolisme nécessite la participation d'enzymes auxiliaires : la Δ3-Δ2-énoyl-CoA isomérase, la Δ2,4-diénoyl-CoA réductase, la Δ2-énoyl-CoA hydratase ou la 3-hydroxyacyl-CoA épimérase et la Δ3,5-Δ2,4-diénoyl-CoA isomérase. Bon nombre de ces enzymes sont présentes sous forme d'isoformes situées dans plusieurs compartiments sub-cellulaires, tandis que d'autres font partie d'enzymes multi-fonctionnelles du système de la β-oxydation. |
|
La première partie de la β-oxydation est l'activation des acides gras dans le cytoplasme par formation d'une liaison thioester entre le groupement carboxyle de l'acide gras et le groupe thiol du coenzyme A. Les acides gras deviennent des acyl-CoA. L'activation nécessite l'hydrolyse de l'ATP. Cette réaction est catalysée par l'acyl-CoA synthétase ou acyl-thiokinase. Il existe différentes acyl-CoA synthétases pour des acides gras de longueurs différentes.
|
Le coenzyme A ou CoA ou CoA-SH Il permet les réactions de transfert des groupes acyles (R-C=O). Ces groupes sont liés au coenzyme A par des liaisons thioester, liaisons à haut potentiel énergétique (ΔG°' = - 9 kcal/mol).
Le coenzyme A est un dérivé de l'acide pantoténique, vitamine de la famille des vitamines B. Remarque : l'adénosine 3', 5' -diphosphate n'est pas à confondre avec l'ADP = adénosine 5' -diphosphate. |
3. Entrée dans la mitochondrie : rôle de la carnitine Les membranes mitochondriales sont imperméables aux acyl-CoA à longues chaînes. Ils la franchissent en étant convertis en acyl-carnitine à partir de la carnitine (synthétisée dans le foie à partir de la lysine). L'entrée dans la matrice s'effectue via :
|
Les carnitine acyltransférases Elles catalysent la réaction : acyl-CoA + L-carnitine <=> CoA-SH + L-acylcarnitine La famille des carnitine acyltransférases inclue :
Elle sont situées sur le feuillet côté cytosol de la membrane externe de la mitochondrie.
Figure ci-dessous : mécanisme catalytique des carnitine acyltransférases.
Le résidu catalytique His 343 peut arracher un proton (mécanisme de catalyse base générale) à la carnitine ou au CoA-SH. La forme oxyanion de l'intermédiaire tétraédrique est stabilisée par des interactions avec la carnitine et le groupement hydroxyle de la chaîne latérale de Ser 554. |
|
Visualisation de la carnitine acétyltransférase de Mus Musculus à une résolution de 1,9 Å. Code PDB : 1NDI Remarque : seule la chaîne A est représentée.
|
|
La carnitine-acylcarnitine translocase ("Mitochondrial carnitine/acylcarnitine carrier protein" - CAT) transporte les acyl-carnitines de différentes longueurs du cytosol vers la matrice mitochondriale à travers la membrane mitochondriale interne. Il s'agit d'un antiport : les acyl-carnitines sont échangés contre la carnitine libre.
La structure des CAT est typique de la famille des transporteurs mitochondriaux avec 3 segments répètés d'une centaine d'acides aminés, chacun contenant le motif signature PX[DE]XX[RK]. Autres protéines D'autres protéines interviennent dans le transport et le catabolisme des acides gras, parmis lesquelles :
|
4. La β-oxydation a. Les réactions d'un tour d'hélice des acides gras saturés 4 étapes sont nécessaires pour transformer l'acyl-CoA d'acide gras mitochondrial en acétyl-CoA. 1ère étape : L'acyl-CoA déshydrogénase (E.C. 1.3.8.9) forme un acyl-CoA (α-β) insaturé, par oxydation avec transfert d'électrons à l'ubiquinone (Q) via des transporteurs intermédiaires :
Chez les Mammifères, il existe 3 groupes d'acyl-CoA déshydrogénases : acides gras à chaînes courtes (4 - 6 C), moyennes (6 - 10 C) et longues (12 - 18 C). L'acyl-CoA déshydrogénase des acides gras à longues chaînes est attachée à la membrane interne de la mitochondrie. Les autres sont solubles dans la matrice. Un résidu glutamate du site actif et la position du FAD à l'opposé de ce glutamate jouent un rôle capital dans la stéréospécificité de la réaction : l'isomère trans est formé. Figure ci-dessous : les 4 réaction de la β-oxydation.
|
2ème étape : La réaction d'hydratation catalysée par l'enoyl-CoA hydratase (E.C. 4.2.1.17) est stéréospécifique : l'énoyl-CoA est hydraté pour former l'isomère L du 3-hydroxyacyl-CoA. La plupart des doubles liaisons des acides gras d'origine naturelle sont en configuration cis. Comme 2 atomes de carbone sont retirés à chaque tour d'hélice, une double liaison peut aboutir à une mauvaise configuration pour servir de substrat à l'énoyl-CoA hydratase. 3éme étape : L'oxydation qui suit par le NAD+ est catalysée par la L-β-hydroxyacyl-CoA déshydrogénase (E.C. 1.1.1.35). Le groupement hydroxyle est transformé en fonction cétone : formation du 3-cétoacyl-CoA. 4éme étape : La dernière réaction d'un tour de la de la β-oxydation est une thiolyse catalysée par la β-cétoacyl-CoA thiolase (E.C. 2.3.1.16) - appelée aussi acétyl-CoA acyltransférase :
Tours suivants de l'hélice : Cet acyl-CoA à (n-2) carbones devient le nouveau substrat de cette série de 4 réactions jusqu'à ce que la molécule d'acide gras initial soit convertie en acétyl-CoA. Au fur et à mesure que la chaîne raccourcit, les différentes isoenzymes d'acyl-CoA déshydrogénases interviennent. Il est à noter qu'il existe une forte ressemblance chimique de certaines étapes de la β-oxydation et du cycle de Krebs. |
|
b. Bilan de la β-oxydation des acides gras saturés acyl-CoA à n carbones + FAD (coenzyme Q) + NAD+ + CoA-SH + H2O => acyl-CoA à (n-2) carbones + FADH2 (coenzyme QH2) + NADH + H+ + acétyl-CoA Pour un acide gras à n carbones, il y a :
Exemple : palmityl-CoA + 7 FAD (coenzyme Q) + 7 NAD+ + 7 CoA-SH + 7 H2O => 1 acétyl-CoA + 7 FADH2 (coenzyme QH2) + 7 NADH + 7 H+ + 7 acétyl-CoA Si l'acide gras contient un nombre pair de carbones, le butyryl-CoA final est converti en 2 acétyl-CoA. L'équivalence en ATP est la suivante : 8 acétyl-CoA produisent 96 ATP, 7 FADH2 produisent 14 ATP et 7 NADH produisent 21 ATP, soit un total de 131 ATP. L'activation de l'acide palmitique en palmityl-CoA nécessitant 2 ATP, le rendement net est 129 ATP par molécule de palmitate oxydé. A nombre de carbones équivalents, un acide gras génère plus de molécules d'ATP qu'un ose : par exemple, le glucose ne fournit que 38 ATP (le bilan étant à rapporter au nombre de carbones : 16 pour le palmitate et 6 pour le glucose). Les oses sont déjà des molécules en partie oxydées. L'acétyl-CoA n'est pas converti intégralement en glucose, sauf chez les organismes qui possèdent le cycle du glyoxylate. Comme l'acétyl-CoA est le principal composé formé par la β-oxydation des acides gras, ceux-ci ne se transforment généralement pas en glucides chez les animaux. |
c. La β-oxydation des acides gras à nombre impair de carbones La plupart des acides gras naturels contiennent un nombre pair d'atomes de carbone. Il existe cependant des acides gras à nombre impair de carbone synthétisés, par exemple, par les bactéries des estomacs des ruminants. Leur oxydation passe par les mêmes étapes que celles des acides gras à nombre pair d'atomes de carbone. Il existe cependant des enzymes supplémentaires : en effet, le dernier tour d'hélice de la β-oxydation d'un acide gras à nombre impair de carbone débouche sur l'acétyl-CoA et le propionyl-CoA (à 3 atomes de carbone). Le propionyl-CoA est converti en succinyl-CoA, un intermédiaire du cycle de Krebs.
a. La propionyl-CoA carboxylase - enzyme à biotine - qui catalyse l'incorporation de bicarbonate au propionyl-CoA pour former du D-méthylmalonyl-CoA. b. La méthylmalonyl-CoA racémase (ou épimérase R/S) : conversion du D(R)-méthylmalonyl-CoA en L(S)-méthylmalonyl-CoA. c. La méthylmalonyl-CoA mutase qui forme le succinyl-CoA. Cette enzyme nécessite le cofacteur adénosylcobalamine, dérivée de la vitamine B12. |
d. La β-oxydation des acides gras insaturés Les acides gras insaturés sont bien représentés dans la nature. Les acides gras poly-insaturés contiennent à la fois des liaisons doubles à numéro pair et des liaisons doubles à numéro impair, car les liaisons doubles sont en général séparées par un groupe méthylène. Par exemple, le linoléate (C18,cis,cis-Δ9,12-octadécadiénoate) possède une double liaison de chaque type. Comme dans le cas des autres acides gras insaturés, le linoléyl-CoA est un substrat de la β-oxydation jusqu'à ce que la double liaison d'une chaîne raccourcie interfère avec le processus catalytique. Àprès 3 tours d'hélice, le linoléyl-CoA est transformé en C12,cis,cis-Δ3,6-diénoyl-CoA. Cette molécule possède une liaison double (cis-β,γ) au lieu d'une liaison double (trans-β,γ) : elle ne peut pas être un substrat de l'énoyl-CoA hydratase. La réaction catalysée par l'énoyl-CoA isomérase réarrange la liaison Δ3 en Δ2 pour former le C12,trans,cis-Δ2,6-diénoyl-CoA. Celui-ci rejoint la β-oxydation où il y subit 1 tour complet pour former le C10,cis-Δ4-énoyl-CoA. Celui-ci est transformé en C10,trans,cis-Δ2,4-diénoyl-CoA par l'acyl-CoA déshydrogénase (l'enzyme qui catalyse la 1ère étape de la β-oxydation).
|
Le C10,trans,cis-Δ2,4-diénoyl-CoA est stabilisé par résonance : sa liaison double ne subit pas l'hydratation. L'addition d'un hydrure au cation et d'un proton à l'anion de l'une des formes résonantes expliquent la position de la liaison double dans le produit formé : C10,trans-Δ3-énoyl-CoA. Celui-ci (comme l'isomère cis au préalable) est un substrat de l'énoyl-CoA isomérase : le produit formé, C10,trans-Δ2-énoyl-CoA, rejoint la β-oxydation.
|
|
La β-oxydation génère l'acétyl CoA qui entre dans le cycle de Krebs. S'il y a trop d'acétyl CoA formé, ou durant le jeûne (pendant lequel l'oxaloacétate est épuisé dans le foie car il est utilisé pour la néoglucogénèse), l'acétyl-CoA en excès est converti dans les mitochondries du foie en corps cétoniques : acétoacétate, β-hydroxybutyrate et acétone. Les acides aminés dits cétogènes qui alimentent le cycle de Krebs (par exemple la leucine), forment de l'acétoacétate et de l'acétyl-CoA et, par voie de conséquence, sont susceptibles de contribuer à la formation de corps cétoniques. Chez les Mammifères, la cétogénèse a lieu dans la matrice des mitochondries de cellules du foie.
Quatre enzymes sont impliquées dans la synthèse des corps cétoniques : β-cétothiolase (Acétyl-CoA acétyltransférase - E.C. 2.3.1.9) : la dernière étape de la voie de la β-oxydation a lieu en sens réverse, 2 acétyl-CoA se condensent pour former l'acétoacétyl-CoA, avec libération de d'un CoA-SH. Elle est aussi impliquée dans la voie du mévalonate. HMG-CoA synthase (E.C. 2.3.3.10) : elle catalyse la condensation d'une troisième portion d'acétate (de l'acétyl-CoA) avec l'acétoacétyl-CoA pour former le β-hydroxy-β-méthylglutaryl-CoA (HMG-CoA). Elle est aussi impliquée dans la voie du mévalonate. HMG-CoA lyase (E.C. 4.1.3.4) : elle clive le HMG-CoA pour former l'acétoacétate et l'acétyl-CoA. Il y a ensuite une décarboxylation non enzymatique de l'acétoacétate et formation d'acétone. β-hydroxybutyrate déshydrogénase (E.C. 1.1.1.30) : elle catalyse l'interconversion de l'acétoacétate et du β-hydroxybutyrate. Elle a besoin de la phosphatidylcholine comme activateur allostérique. |
L'acétoacétate et le β-hydroxybutyrate traversent la membrane mitochondriale puis la membrane plasmique et rejoignent la circulation sanguine. Une petite proportion de l'acétoacétate se décarboxyle en acétone dans le sang. Les corps cétoniques sont transportés par le sang dans les cellules d'autres organes. Une fois dans ces cellules, l'acétoacétate et le β-hydroxybutyrate rejoignent les mitochondries :
Le β-hydroxybutyrate est transformé en acétoacétate par une β-hydroxybutyrate déshydrogénase, isoenzyme distincte de l'enzyme du foie. L'acétoacétate réagit avec le succinyl-CoA pour former l'acétoacétyl-CoA, réaction catalysée par la succinyl-CoA transférase. Cette réaction détourne du cycle de Krebs une certaine quantité de succinyl-CoA : l'énergie qui aurait servi à former du GTP par phosphorylation au niveau du substrat par la succinyl-CoA synthétase est détournée pour activer l'acétoacétate en acétoacétyl-CoA . L'acétoacétyl-CoA est ensuite converti en 2 molécules d'acétyl-CoA par la thiolase. L'acétyl-CoA entre dans le cycle de Krebs afin de générer de l'ATP. Les corps cétoniques servent donc de combustible. Bien qu'ils contiennent une énergie métabolique potentielle moindre que les acides gras dont ils dérivent, ils servent de "lipides hydrosolubles" plus aptes que les acides gras à une oxydation rapide dans le coeur et le rein. Pendant le jeûne, les corps cétoniques sont produits en grande quantité et leur concentration sanguine augmente au point qu'ils se substituent au glucose en tant que principal combustible du cerveau. Alors que les corps cétoniques fonctionnent comme "fuel" cellulaire alternatif, les acides aminés doivent être dégradés pour approvisionner l'entrée dans la néoglucogénèse en cas d'hypoglycémie, car l'acétate ne peut pas être converti en glucose. |
| 6. Liens Internet et références bibliographiques |
|
"Lipid Catabolism: Fatty Acids & Triacylglycerols" "Fatty Acid Oxidation" |
|
|
Knoop F. (1904) "Der Abbau aromatischer Fettsäuren im Tierkörper" Beitr. Chem. Physiol. Pathol. 6, 150 - 162 Fritz & McEwen (1959) "Effects of carnitine on fatty-acid oxidation by muscle" Science 129, 334–335 Houten & Wanders (2010) "A general introduction to the biochemistry of mitochondrial fatty acid β-oxidation" J. Inherit. Metab. Dis. 33, 469 - 477 |
|
| Jogl & Tong (2003) "Crystal Structure of Carnitine Acetyltransferase and Implications for the Catalytic Mechanism and Fatty Acid Transport" Cell 112, 113 - 122 | Article |