
| Étapes préalables au cycle de Krebs : translocation du pyruvate et conversion du pyruvate en acétyl CoA |
| Tweet |
 |
|
1. Introduction 2. Translocation du pyruvate : la pyruvate translocase 3. Le complexe de la pyruvate déshydrogénase
|
4. Liens Internet et références bibliographiques |
|
1. Introduction Au laboratoire, on peut oxyder complètement en CO2 et H2O les substances organiques composées de carbone, d'hydrogène et d'oxygène en les brûlant dans l'air. Cependant, on libère l'énergie sous forme de châleur. Dans les cellules des organismes aérobies, le pyruvate formé à l'issue de la glycolyse est oxydé en CO2 et H2O par une série de réactions enzymatiques au cours desquelles une partie de l'énergie est stockée sous forme d'une molécule à haut potentiel énégétique :
La première étape enzymatique dans la conversion du pyruvate en CO2 et H2O est une décarboxylation (formation de CO2) oxydante :
Puis, l'oxydation du groupe acétyle de l'acétyl-CoA s'effectue dans le cycle de Krebs (aussi appelé cycle du citrate ou cycle des acides tricarboxyliques qui sont les intermédiaires de ce cycle). L'énergie issue des réactions d'oxydation de ce cycle est convertie en pouvoir réducteur, sous la forme de coenzymes réduits (NADH et FADH2). Chez les Eucaryotes, les 2 étapes préalables au cycle de Krebs sont donc : a. L'entrée du pyruvate, formé par la glycolyse dans le cytosol, dans les mitochondries. Cette entrée s'effectue :
b.La transformation dans la mitochondrie du pyruvate en acétyl-CoA catalysée par la pyruvate déshydrogénase. |
2. Translocation du pyruvate : la pyruvate translocase La membrane interne de la mitochondrie est imperméable aux petites molécules comme le pyruvate. Le pyruvate issu de la glycolyse pénètre dans la mitochondrie (de l'espace intermembranaire dans la matrice) via la pyruvate translocase (protéine de la membrane interne). Ce transport est un symport avec H+. Ces protons sont ceux qui sont concentrés dans l'espace intermembranaire par la chaîne respiratoire.
C'est la composante chimique (ΔpH) de la force proton motrice (générée par le gradient de protons au cours de la chaîne respiratoire) qui apporte l'énergie nécessaire à ce transport. Le phénylpyruvate qui s'accumule dans le sang en cas de phénylcéto-urée est un puissant inhibiteur de la pyruvate translocase. En 2012, un transporteur mitochondrial du pyruvate ("Mitochondrial Pyruvate Carrier "- MPC) a été mis en évidence. Il s'agit d'un hétéro-complexe (environ 150 kDa) formé par 2 membres (MPC1 et MPC2) d'une famille de protéines membranaires non caractérisées ("Family MPC / PF03650"). Ces protéines membranaires sont conservées de la levure au mammifères. |
|
3. Le complexe de la pyruvate déshydrogénase a. Conversion du pyruvate en acétyl-CoA Le complexe multi-enzymatique (et multi co-facteurs) de la pyruvate déshydrogénase (ou pyruvate:NADP+ oxidoréductase ou PDH - EC 1.2.1.51) catalyse la transformation du pyruvate en acétyl-CoA.
Cette réaction fait intervenir le coenzyme A (ou CoA ou CoASH). Le coenzyme A est un dérivé de l'acide pantothénique, vitamine de la famille des vitamines B. Remarque : l'adénosine 3', 5' -diphosphate n'est pas à confondre avec l'ADP = adénosine 5' -diphosphate.
Le coenzyme A ou CoA ou CoASH est la molécule qui permet les réactions de transfert des groupes acyles (R-C=O), comme celles du catabolisme des acides gras. Ces groupes sont liés au coenzyme A par des liaisons thioester, liaisons à haut potentiel énergétique (ΔG°' = - 9 kcal/mol). |
Structure du complexe de la pyruvate déshydrogénase La PDH est l'un des plus gros complexes multi-enzymatiques connus. Exemple : la PDH de Escherichia coli contient 60 sous-unités pour une masse molaire de 5 106 à 1 107 Daltons.
Source : "Principes de Biochimie" - Horton et al. (1994) La taille de ce complexe est si grande qu'il s'apparente à une particule (comme les ribosomes ou le spliceosome). De plus, le complexe est si flexible qu'il a fallu des années pour en déterminer une structure globale par 3 techniques : diffraction des rayons X/cristallographie, RMN et cryomicroscopie électronique. En septembre 2012, elle a fait l'objet d'un article complet "Molecule of the month" de la PDB.
Source : NIH |
| Enzyme | E.C. | structure | co-facteur | sous-unités |
sous-unités |
| pyruvate déshydrogénase | 1.2.4.1 | tétramère α2β2 E1 en bleu | pyrophosphate de thiamine | 24 | 2 à 30 |
| dihydrolipoamide acétyltransférase | 2.3.1.12 | homodimère E2 en vert | acide lipoïque et coenzyme A | 24 | 60 |
| dihydrolipoamide déshydrogénase | 1.8.1.4 | homodimère E3 | FAD et NAD+ | 12 | 6 à 12 |
|
b. Détail du mécanisme de la réaction catalysée par le complexe de la pyruvate déshydrogénase
Source : "Principes de Biochimie" - Horton et al. (1994) 1ère étape : la sous-unité E1 (pyruvate déshydrogénase) catalyse la décarboxylation du pyruvate (partie gauche du schéma ci-dessous).
2ème étape : HETPP est transféré de la sous-unité E1 au groupe prosthétique lipoamide de la sous-unité E2 (dihydrolipoamide acétyltransférase).
3ème étape : La sous-unité E3 (dihydrolipoamide déshydrogénase) catalyse la réoxydation du groupe lipoamide réduit et la sous-unité E2 peut participer à un nouveau cycle catalytique.
En conséquence, l'étape de formation de l'acétyl-CoA contribue aussi à la synthèse finale d'ATP via le NADH formé (chaîne respiratoire ==> gradient de protons ==> force proton motrice). |
| Résumé des coenzymes du complexe de la pyruvate déshydrogénase | ||
| pyrophosphate de thiamine | 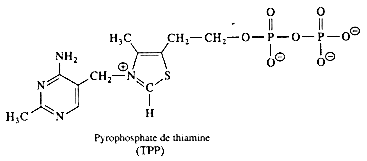 |
|
| acide lipoïque | 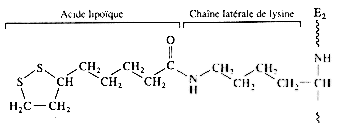 |
|
| coenzyme A | FAD | NAD+ |
La flavine adénine dinucléotide (FAD) De nombreuses protéines appelées flavoenzymes comportent un groupe prosthétique qui participe au mécanisme catalytique :
Source : "Principes de Biochimie" - Horton et al. (1994)
Le centre réactionnel est un noyau aromatique tricyclique, l'isoalloxazine (la partie en rouge):
|
|
c. Régulation de l'activité de la pyruvate déshydrogénase L'activité de la PDH est très finement régulée car elle joue un rôle central dans le métabolisme énergétique : en effet, la réaction catalysée par la PDH met en relation la glycolyse, la néoglucogenèse et l'oxydation des acides gras avec le cycle de Krebs. De plus, l'activité de la PDH est importante également dans la régulation du flux de la transformation du glucose en malonyl-CoA, nécessaire à la synthèse des acides gras.
L'activité de la sous-unité E1 est régulée par :
La régulation allostérique des sous-unités E2 et des sous-unités E3 contrôle la quantité d'acétyl-CoA produite à partir du pyruvate. Elle établit donc un lien avec le flux de la glycolyse. En général, les substrats de la PDH sont des activateurs et les produits de la PDH sont des inhibiteurs.
Voir un cours sur les mécanismes enzymatiques à plusieurs substrats et plusieurs produits. |
| 4. Liens Internet et références bibliographiques |
|
"Pyruvate Dehydrogenase Complex : PDB Molecule of the Month - September 2012" "Biocarta" : site interactif sur la signalisation cellulaire "The UCSD-Nature Signaling Gateway" - A comprehensive resource for information about cell signaling "Pyruvate metabolism" - KEGG PATHWAY Database |
|
|
Bricker et al. (2012) "A mitochondrial pyruvate carrier required for pyruvate uptake in yeast, Drosophila, and humans" Science 337, 96 - 100 Herzig et al. (2012) "Identification and functional expression of the mitochondrial pyruvate carrier" Science 337, 93 - 96 |