Métabolisme mitochondrial lié à la chaîne respiratoire |
|
1. La mitochondrie et la chaîne respiratoire 2. Caractéristiques générales des complexes protéiques de la chaîne respiratoire 3. Rôles biologiques des formes réduites NADH et NADPH 4. Les systèmes de navette pour transporter le pouvoir réducteur a. La navette glycérol phosphate 5. La force proton-motrice et la synthèse d'ATP par l'ATP synthase 6. Transport du Pi, de l'ADP et de l'ATP a. Transport du Pi au travers de la membrane interne |
7. Découplage [dissipation du gradient de protons / synthèse d'ATP] a. Les protéines de découplage de ces 2 processus 8. Les espèces réactives de l'oxygène de la mitochondrie a. Généralités 9. Quelques inhibiteurs et agents découplants de la chaîne respiratoire 10. Liens Internet et références bibliographiques |
| Texte des énoncés des exercices de TD - L2 - P8. |
|
|
| 1. La mitochondrie et la chaîne
respiratoire
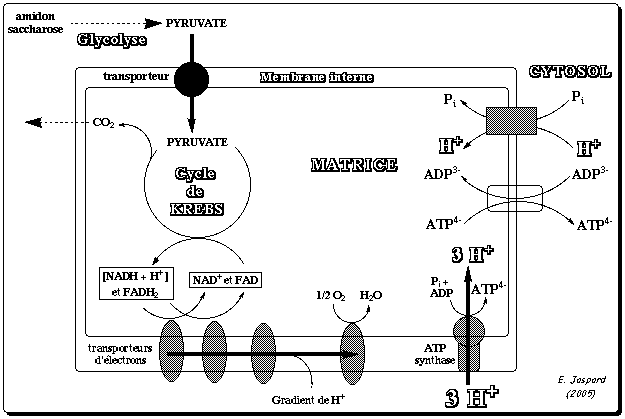
La mitochondrie est limitée par deux membranes caractérisées par des propriétés très différentes : La membrane externe est pauvre en protéines. Elle contient, en particulier, des protéines transmembranaires, les porines, qui permettent le passage des ions et des métabolites hydrosolubles de masse molaire < 7000 Daltons. A l'inverse, la membrane interne est très riche en protéines mais elle est quasiment imperméable aux ions et aux métabolites hydrosolubles. Ces substances ne peuvent traverser la membrane qu'à l'aide de protéines membranaires de transport (l'ATP, l'ADP et le Pi sont transportés par ce type de protéines), ou de systèmes plus complexes qu'on appelle navette. L'espace entre ces deux membranes s'appelle l'espace intermembranaire. La zone interne de la mitochondrie (bordée par la membrane interne) s'appelle la matrice. Elle contient les enzymes du cycle de Krebs et la plupart de celles qui catalysent l'oxydation des acides gras. La chaîne respiratoire est localisée dans la membrane interne des mitochondries. Le nombre des crêtes accroit la surface de cette membrane et ainsi chaque mitochondrie contient des milliers d'exemplaires de la chaîne de transport d'électrons. Les crêtes pénètrent dans la matrice. Certaines protéines mitochondriales sont synthétisées par la mitochondrie (génome mitochondrial), mais la plupart d'entre elles sont codées par le génome nucléaire puis importées dans la mitochondrie. Voir un cours sur la biogénèse (synthèse, adressage et assemblage) des protéines membranaires intégrales. |
| 2.
Caractéristiques générales des complexes protéiques de la chaîne respiratoire
La chaîne respiratoire est un ensemble de complexes protéiques qui assurent un transfert de protons et/ou d'électrons. Les caractéristiques des complexes protéiques sont les suivants : |
| Règne | Complexe ou protéine | Sous-unités | Masse molaire | Composants | Transfert | Inhibiteurs |
| Animaux et végétaux | NADH - coenzyme Q |
25 | 800 kDa | 1 FMN 22 à 24 atomes [Fe - S] dans 5 à 8 centres | électrons protons |
roténone amytal |
| succinate
- coenzyme Q oxydoréductase (complexe II) |
4 | 125 kDa | 1 FAD 7 à 8 atomes Fe - S dans 3 centres cytochrome b560 | électrons | malonate | |
| coenzyme Q | 1 | 0,86 | lipide isoprénoide | électrons protons |
----- | |
| Spécifiques des végétaux | NAD(P)H déshydrogénases | 4 protéines : 2 NDint et 2 NDext cytochrome b560 | électrons | diphénylèneiodonium (DPI) insensibles à la roténone | ||
| oxydase alternative (AOX) | 2 | 64 kDa | électrons | SHAM propylgallate insensible au KCN | ||
| Animaux et végétaux | coenzyme Q
- cytochrome c oxydoréductase (complexe III) |
8 | 220 kDa | 2 centres [Fe - S] cytochrome b560 cytochrome b566 cytochrome c1 | électrons protons |
antimycine |
| cytochrome C | --- | 12 kDa | hème (Fe) | électron | ----- | |
| cytochrome c oxydase (complexe IV) |
12 | 200 kDa | cytochrome a cytochrome a3 2 ions cuivre |
électrons protons |
KCN / CO / NaN3 |
3. Rôles biologiques des formes réduites NADH et NADPH Malgré des structures très semblables, les formes réduites de ces deux coenzymes sont employées dans la cellule de manière très différente. Le NADH est produit par des réactions de voies du catabolisme (dégradation) :
Le NADPH est produit par des réactions de voies de l'anabolisme (biosynthèse) telles que la voie des pentoses phosphate.
|
|
4. Les systèmes de navette ("shuttle") pour transporter le pouvoir réducteur Au cours de la glycolyse, 2 molécules de NAD réduit (NADH) sont formées par molécule de glucose dégradé.
|
a. La navette glycérol phosphate Elle met en jeu 2 enzymes :
Le pouvoir réducteur entre dans la mitochondrie de la manière suivante :
|
b. La navette malate - aspartate Elle met en jeu de nombreuses enzymes et transporteurs membranaires : en particulier, la malate déshydrogénase (MDH1 et MDH2 - E.C. 1.1.1.37) et l'aspartate transaminase (GOT1 et GOT2, E.C. 2.6.1.1), présentes à la fois dans le cytosol et dans la mitochondrie. Les principales étapes du mécanisme sophistiqué par lequel le pouvoir réducteur du NADH entre dans la mitochondrie sont les suivantes :
En conséquence, 3 molécules d'ATP sont synthétisées lors de la réoxydation du NADH formé au cours de la glycolyse quand le pouvoir réducteur entre dans la mitochondrie via la navette malate - aspartate. |
5. La force proton-motrice et la synthèse d'ATP par l'ATP synthase La théorie chimio-osmotique formulée par Peter Mitchell en 1961 (Prix Nobel en 1978) postule que :
La réaction de synthèse de l'ATP peut s'écrire de la manière générale suivante : [H+]espace intermembranaire + [ADP + Pi]matrice -> [H+]matrice + [ATP + H2O]matrice |
Vision globale des transporteurs membranaires de la mitochondrie Les complexes de la chaîne de transport d'électrons sont représentés en vert et l'ATP synthase est en bleu (au centre de la figure ci-dessous).
Source : Kunji et al. (2020) |
Q : ubiquinone ; Pi : phosphate inorganique ; ALA : acide aminolévulinique. Les protéines de transport identifiées sont en jaune Les protéines de transport non identifiées sont en violet. |
Transporteurs |
Autres transporteurs mentionnés dans cette figure
|
6. Transport du Pi, de l'ADP et de l'ATP a. Transport du phosphate inorganique au travers de la membrane interne Le phosphate inorganique Pi existe sous différentes formes en résonance :
La résonance décrit les électrons délocalisés d'ions polyatomiques : ce type de molécule est alors représentée par plusieurs structures en résonance. Pi est impliqué dans la synthèse d'ATP selon la réaction : [H+]espace intermembranaire + [ADP + Pi]matrice -> [H+]matrice + [ATP + H2O]matrice Poue que cette réaction ait lieu, Pi est donc importé de l'espace intermembranaire vers la matrice par le transporteur du Pi appelé PiC ("Phosphate Carrier") ou SLC25A3 ("Solute Carrier family 25 member 3"). PiC est un symport qui assure le transport électro-neutre : [Pi / H+]espace intermembranaire -> [Pi / H+]matrice
Figure adaptée de : Kunji et al. (2016) Ce co-transport effectué par PiC illustre l'utilisation de la force proton-motrice pour le fonctionnement de protéines de la membrane interne autres que l'ATP synthase.
|
b. Transport de l'ADP et de l'ATP au travers de la membrane interne La quantité d'ATP nécessaire aux besoins de la cellule hors mitochondrie est exportée de la matrice vers l'espace intermembranaire par un antiport qui transporte l'ADP en sens inverse : la translocase [ADP/ATP] 1 (SLC25A4 - "Solute Carrier family 25 member 4") ou ANT1. C'est l'une des protéines les plus abondantes de la membrane interne des mitochondries qui assure le premier transport et le dernier transport (import d'ADP / export d'ATP) de la phosphorylation oxydative des eucaryotes. On estime que chaque jour, l'équivalent du poids du corps humain en ADP et en ATP est transporté par l'ensemble des translocases des mitochondries de toutes les cellules pour assurer les processus cellulaires nécessitant de l'énergie. La chaîne polypeptidique de la translocase ANT1 :
Figure adaptée de : Kunji et al. (2016) Fonctionnement de la translocase ANT1 C'est un antiport : ADP3-espace intermembranaire + ATP4-matrice -> ADP3-matrice + ATP4-espace intermembranaire
La composante potentiel de membrane mitochondrial ΔΨm du gradient électrochimique de protons est la source d'énergie pour les changements de conformations de cet antiport dans la membrane interne. ANT1 change de conformations entre un état ouvert vers le cytoplasme (état c) et un état ouvert vers la matrice (état m) avec une fixation alternée du ligand sur un seul site qui est orienté alternativement vers le cytosol et vers la matrice. |
c. Autres fonctions de la translocase ANT1 1. ANT1 assure également le transport de protons (fuite de protons - "H+ Leak" - figure ci-dessous ) : H+espace intermembranaire -> H+matrice Cette fonction contribue au découplage des 2 processus [chaîne de transport d'électrons et synthèse d'ATP par l'ATP synthase] qui provoque la thermogenèse mitochondriale. 2. Par ailleurs, l'activité de transport de protons (thermogenèse) de ANT1 est inhibée par son activité antiport [ADP/ATP] pour la synthèse d'ATP (à gauche, figure ci-dessous). ANT1 (SLC25A4) participe donc à la régulation de production d'énergie dans la mitochondrie en maintenant un équilibre entre ces 2 fonctions opposées.
Source : Bround et al. (2020) 3. ANT1 a également un rôle important dans l'ouverture des pores de transition de perméabilité mitochondriale ("Mitochondrial Permeability Transition Pore" - MPTP) de la membrane interne qui s'ouvrent en réponse à une forte élévation de la concentration du Ca2+ dans la matrice : l'organite gonfle puis rompt, provoquant la mort cellulaire. 4. Enfin, ANT1 favorise la mitophagie ("Mitophagy") via son interaction avec TIM44 : la translocase de pré-séquence TIM23 est inhibée, ce qui contribue à stabiliser PINK1. |
d. Transport de l'ATP au travers de la membrane externe Le canal sélectif d'anions dépendant du potentiel de membrane ("Voltage-Dependent Anion-selective Channel" - VDAC) est une protéine membranaire en tonneau β ("β-barrel") de la membrane externe ("outer membrane") de la mitochondrie qui régule l'entrée / sortie de métabolites et d'ions :
VDAC adopte une conformation :
Voir un cours sur les transports. Autres rôles de VDAC Des métabolites tels que NADH et ATP établissent un lien entre la glycolyse (cytosol) et la phosphorylation oxydative (membrane interne de la mitochondrie). En conséquence, le rôle essentiel de VDAC dans le métabolisme énergétique et dans l'homéostasie du calcium en fait une cible thérapeutique importante. Par ailleurs, VDAC participe à la réponse au stress de la mitochondrie en régulant la formation des pores MPTP (voir ci-dessus) formés dans la membrane interne lors d'un fort stress oxydatif ou d'un taux de calcium élevé dans le cytosol. |
7. Découplage des 2 processus [dissipation du gradient de protons et synthèse d'ATP] Les complexes de la chaîne de transport d'électrons sont représentés en vert et l'ATP synthase est en bleu (au centre de la figure).
Source : Kunji et al. (2020)
|
a. Les protéines de découplage de ces 2 processus Six isoformes de protéine de découplage ("UnCoupling Protein" - UCP1 à UCP6) sont identifiées (ou prédites) chez les mammifères.
|
b. UCP1 et la thermogenèse sans frisson La protéine de découplage 1 ("Mitochondrial brown fat uncoupling protein 1" - UCP1) se trouve principalement dans les mitochondries du tissu adipeux brun des mammifères. UCP1 est un symport ("Solute Carrier family 25 member 7" - SLC25A7) qui transporte un proton via un acide gras à longue chaîne. UCP1 est donc également responsable de la perméabilité aux protons de la membrane interne des mitochondries de ce tissu.
Les adipocytes bruns sont donc impliqués dans la production de chaleur lors de la thermogenèse sans frisson (adaptée aux variations de température et d'alimentation). |
|
L'activité de UCP1 :
Les acides gras à longue chaîne ne se dissocient pas de UCP1 en raison des interactions hydrophobes établies par leurs queues hydrophobes.
Source : Crichton et al. (2017) |
| Figure ci-dessus à gauche | Figure ci-dessus à droite |
La noradrénaline (NE) libérée en réponse à un stimulus physiologique active une voie dépendante de l'AMP cyclique (AMPc). Cette voie libère des acides gras à partir des réserves lipidiques cellulaires. |
Les acides gras libres ("Free Fatty Acids") activent (signe +) UCP1 dans les mitochondries, ce qui compense l'inhibition (signe -) de UCP1 par les nucléotides puriques cytosoliques. UCP1 activée dissipe le gradient électrochimique de protons au travers de la membrane interne de la mitochondrie avec un découplage de la synthèse d'ATP. L'énergie libre de Gibbs issue de la réoxydation des substrats de la chaîne respiratoire est libérée sous forme de chaleur ("HEAT"). |
d. Mécanisme du transport du proton par l'acide gras et du transport de l'acide gras anionique par UCP1 Des études de mécanique et de dynamique moléculaires et des expériences de conductance membranaire indiquent que UCP1 transporte des anions d'acides gras.
Source : Vojvodic et al. (2025) Etapes de ce mécanisme :
Les résidus d'acides aminés impliqués dans ce transport sont conservés dans d'autres protéines SLC25 : ce mécanisme de transport pourrait donc s'appliquer à d'autres membres de cette superfamille. |
AR-β3 : récepteur β3-adrénergique / FFA ("Free Fatty Acid") : acides gras libres. "Adipose TriGlyceride Lipase" - ATGL : lipase qui catalyse l'étape initiale de l'hydrolyse des triglycérides dans les gouttelettes lipidiques adipocytes et non adipocytes. "Hormone-Sensitive Lipase" - HSL : lipase (sérine hydrolase) hormono-sensible à spécificité de substrat particulièrement large qui hydrolyse tous les acylglycérols et une grande variété d'esters (de cholestérol, d'acides gras stéroïdiens...). "Carnitine Palmitoyl Transferase 1" - CPT1α : catalyse le transfert [du groupe acyle des conjugués d'acides gras-CoA à longue chaîne] sur la carnitine (absorption des acides gras à longue chaîne dans la mitochondrie pour leur β-oxydation). "Carnitine/AcylCarnitine carrier" - CACT (SLC25A20) : échange électroneutre d'acylcarnitines de différentes longueurs de chaîne acyle avec la carnitine libre à travers la membrane interne mitochondriale (translocation des acylcarnitines dans la matrice). |
Source : Munoz Zamora et al. (2025) |
Si des souris sont replacées dans un environnement où elles ont déjà été soumises à un défi thermique à 4°C, leur métabolisme augmente, quelle que soit la température ambiante réelle. De plus, ces souris ont une activité hypothalamique accrue lorsqu'elles sont exposées au froid car un réseau spécifique émerge entre l'hippocampe et l'hypothalamus lors du rappel d'un souvenir du froid. En conséquence, la réactivation artificielle des engrammes mnésiques sensibles au froid :
L'engramme de mémoire ou mnésique ("memory engram") est la trace biologique de la mémoire dans le cerveau. |
f. Thermogenèse indépendante de UCP1 dans les peroxysomes du tissu adipeux Les peroxysomes assurent diverses fonctions métaboliques, notamment :
Par ailleurs , les peroxysomes :
Les souris [UCP1−/−] ne sont pas obèses, ce qui suggère l'existence d'un mécanisme de thermogenèse indépendant de UCP1.
Les peroxysomes ont donc un rôle dans la thermogenèse du tissu adipeux, caractérisée par un cycle de synthèse et de catabolisme des acides gras à chaîne ramifiée (mécanisme décrit ci-dessous). |
Description du mécanisme de thermogenèse indépendante de UCP1
Source : Liu et al. (2025)
Autres enzymes mentionnées dans la figure : ACSL ("Acyl-CoA Ligase"); BCAT ("Branched-Chain-Amino-acid aminoTransferase"); BCKDH ("Branched-Chain alpha-Keto acid DeHydrogenase") |
|
La cardiolipine (diphosphatidylglycérol) est un glycérophospholipide qui représente 18 à 20% des phospholipides de la membrane interne des mitochondries.
La cardiolipine a de nombreux rôles :
Elle interagit avec le symport PIC, la translocase ANT1, la protéine UCP1, les complexes III et IV de la chaîne respiratoire et l'ATP synthase : elle contribue à l'optimisation de leur structure et à leur orientation pour le transfert des électrons au sein de la chaîne respiratoire. |
8. Les espèces réactives de l'oxygène de la mitochondrie Les espèces réactives de l'oxygène ("Reactive Oxygen Species" - ROS) sont des dérivés de l'oxygène générés par le métabolisme cellulaire de toutes cellules qui utilise l'oxygène.
Les ROS mitochondriales ("mitochondrial ROS" - mtROS) sont générées par les mitochondries. Dans les conditions physiologiques, 0,2 à 2% des électrons de la chaîne de transport des électrons s'en échappent (on parle de fuite d'électrons - "electron leak") et interagissent avec l'oxygène.
Source : Koju et al. (2019) Le superoxyde O2°- est transformé en H2O2 par des superoxyde dismutases (oxydoréductases) : 2 H+ + 2 O2°- <=> H2O2 + O2
|
|
Effets bénéfiques
Effets léthaux Un excès de ROS peut provoquer des dommages cellulaires irréversibles, voire la mort cellulaire. La survenue de nombreuses maladies et l'hypoxie sont étroitement liées à l'augmentation de la production de ROS. |
c. Sélénium : UCP1, séléno-cystéine et ROS Le sélénium (34Se) est impliqué dans le métabolisme énergétique des mitochondries et dans la capacité thermogénique du tissu adipeux.
Source : Takeda et al. (2023) |
| Figure ci-dessus à gauche dans le cercle | Figure ci-dessus à droite dans le cercle |
La sélénocystéine (Sec) peut être incorporée de manière facultative dans UCP1 (Jedrychowski et al., 2020). Si cette incorporation a lieu, elle s'effectue spécifiquement sur la cystéine en position 253 et forme la sélénocystéine 253 (Sec253) qui régule la fonction métabolique de UCP1. UCP1-Sec253 est très sensible aux variations du potentiel rédox dans la mitochondrie car les sélénols ont une réactivité accrue vis-à-vis des ROS. |
Le sélénium délivré par les sélénoprotéines (SeP) dans les mitochondries active la glutathion peroxydase 4 (GPX4), enzyme anti-oxydante dépendante du sélénium. |
La supplémentation alimentaire en sélénium :
|
En conséquence :
|
9. Quelques inhibiteurs et agents découplants des processus de la respiration
Source : O'Rourke et al. (2005) |
| Processus ou complexe inhibés | Exemples d'inhibiteur ou d'agent découplant |
| Inhibiteurs de la phosphorylation qui empêchent la consommation d'oxygène après l'addition d'ADP mais n'ont pas d'effet sur la stimulation de la respiration par les agents découplants. | oligomycine |
Agents découplants
|
2,4 dinitrophénol carbonyl cyanide m-chloro-phenyl hydrazone (CCCP) p-trifluoromethoxy-carbonyl-cyanide-phenyl hydrazone (FCCP) |
| Inhibition de l'antiport DIC ("DiCarboxylate Carrier" - SLC25A10) qui échange des acides dicarboxyliques (par exemple, le malate ou le succinate) contre le Pi. | butylmalonate |
| Inhibition du transport de l'ADP ou de l'ATP (translocase ANT1) au travers de la membrane interne (empêche l'exportation de l'ATP ou l'importation de l'ADP). La fixation de l'atractyloside et du BKA ont des effets opposés sur l'efflux des nucléotides par la translocase. |
atractyloside (glycoside diterpénoïde) N-éthyl maléimide acide bongkrekique (BKA) carboxy-atractylate |
| Flux de protons médié par UCP1. | inhibiteurs : ATP, ADP, GTP et GDP activateurs : ROS et acides gras |
| Ionophores qui rendent la membrane interne perméable à des composés qui normalement ne peuvent pas la traverser. | valinomycine, nigericine |
| NADH - coenzyme Q oxydoréductase (complexe I) | roténone |
| succinate - coenzyme Q oxydoréductase (complexe II) | acide malonique |
| coenzyme Q - cytochrome c oxydoréductase (complexe III) | antimycine A |
| cytochrome c oxydase (complexe IV) | KCN (cyanure de potassium) / CO / NaN3 (azoture de sodium) |
| Pour plus de détails, aller au site "Uncouplers and Inhibitors". | |
| Texte des énoncés des exercices de TD - L2 - P8. |
| 10. Liens Internet et références bibliographiques |
|
"Principes de Biochimie" Horton, Moran, Ochs, Rawn et Scrimgeour (1994) - Ed. DeBoeck Universités - ISBN : 2-8041-1578-X |
|
ROSMETER: a tool for identification of reactive oxygen species (ROS) transcriptomic signatures |
ROSMETER |
Nicholls & Locke (1984) « Thermogenic mechanisms in brown fat » Physiol. Rev. 64, 1 - 64 O'Rourke et al. (2005) "Mitochondrial Ion Channels: Gatekeepers of Life and Death" Physiology (Bethesda) 20, 303 - 315 |
|
|
Kunji et al. (2016) "The transport mechanism of the mitochondrial ADP/ATP carrier" Biochim. Biophys. Acta 1863, 2379 - 2393 Crichton et al. (2017) "The molecular features of uncoupling protein 1 support a conventional mitochondrial carrier-like mechanism" Biochimie 134, 35 - 50 Xiao et al. (2018) "NAD(H) and NADP(H) Redox Couples and Cellular Energy Metabolism" Antioxid. Redox Signal. 28, 251 - 272 |
|
Koju et al. (2019) "Pharmacological strategies to lower crosstalk between nicotinamide adenine dinucleotide phosphate (NADPH) oxidase and mitochondria" Biomed. Pharmacother. 111, 1478 - 1498 Zhao et al. (2019) "Mitochondrial electron transport chain, ROS generation and uncoupling" Int. J. Mol. Med. 44, 3 - 15 |
|
Kunji et al. (2020) "The SLC25 Carrier Family: Important Transport Proteins in Mitochondrial Physiology and Pathology" Physiology (Bethesda) 35, 302 - 327 Bround et al. (2020) "A 20/20 view of ANT function in mitochondrial biology and necrotic cell death" J. Mol. Cell. Cardiol. 144, A3 - A13 Jedrychowski et al. (2020) "Facultative protein selenation regulates redox sensitivity, adipose tissue thermogenesis, and obesity" Proc. Natl. Acad. Sci. 117, 10789 - 10796 |
|
Takeda et al. (2023) "Mitochondrial Energy Metabolism in the Regulation of Thermogenic Brown Fats and Human Metabolic Diseases" Int. J. Mol. Sci. 24, 1352 Zhang et al. (2023) "SLC25 family with energy metabolism and immunity in malignant tumors" Oncologie 26, 0280 New et al. (2023) "ROS Consumers or Producers? Interpreting Transcriptomic Data by AlphaFold Modeling Provides Insights into Class III Peroxidase Functions in Response to Biotic and Abiotic Stresses" Int. J .Mol. Sci. 24, 8297 |
|
Vojvodic et al. (2025) "Molecular Dynamics Simulations of a Putative Novel Mechanism for UCP1-Assisted FA Anion Transport" Acta Physiol (Oxf) 241, e70068 Munoz Zamora et al. (2025) "Cold memories control whole-body thermoregulatory responses" Nature 641, 942 - 951 Liu et al. (2025) "Peroxisomal metabolism of branched fatty acids regulates energy homeostasis" Nature 646, 1223 - 1231 |
|